Les points essentiels
Afin d'optimiser la démarche thérapeutique, la prescription du médicament doit s'effectuer avec une connaissance parfaite des relations reliant la concentration ou la dose administrée aux effets thérapeutiques qu'elle engendre ainsi qu'aux effets indésirables qu'elle peut faire apparaître.
La recherche de la relation entre la concentration du médicament et les effets pharmacologiques engendrés sur différents modèles expérimentaux est indispensable.
>>> Quantification de l'effet pharmacodynamique
Ehrlich et Langley il y a un siècle constataient déjà l'existence d’une relation entre la dose administrée et l'effet obtenu, Clark développa l'hypothèse selon laquelle l'interaction médicament-récepteur est une réaction réversible gouvernée par la loi d'action de masse. Selon cette théorie de l'occupation des récepteurs, l'effet pharmacodynamique du médicament est proportionnel au nombre de récepteurs occupés (figure 1) :
Figure 1 : Théorie de l'occupation des récepteurs

Selon cette théorie plus la capacité de fixation, appelée affinité, de M sur R est élevée plus l’équilibre est déplacé vers la droite et l’effet pharmacologique qui en résulte est important. Cette théorie néglige les mécanismes cellulaires d’amplification et le caractère multifactoriel de la réponse.
Si M active le récepteur c’est un agoniste.
Si M n’active pas le récepteur c’est un antagoniste
Figure 2 : Relation concentration - effet
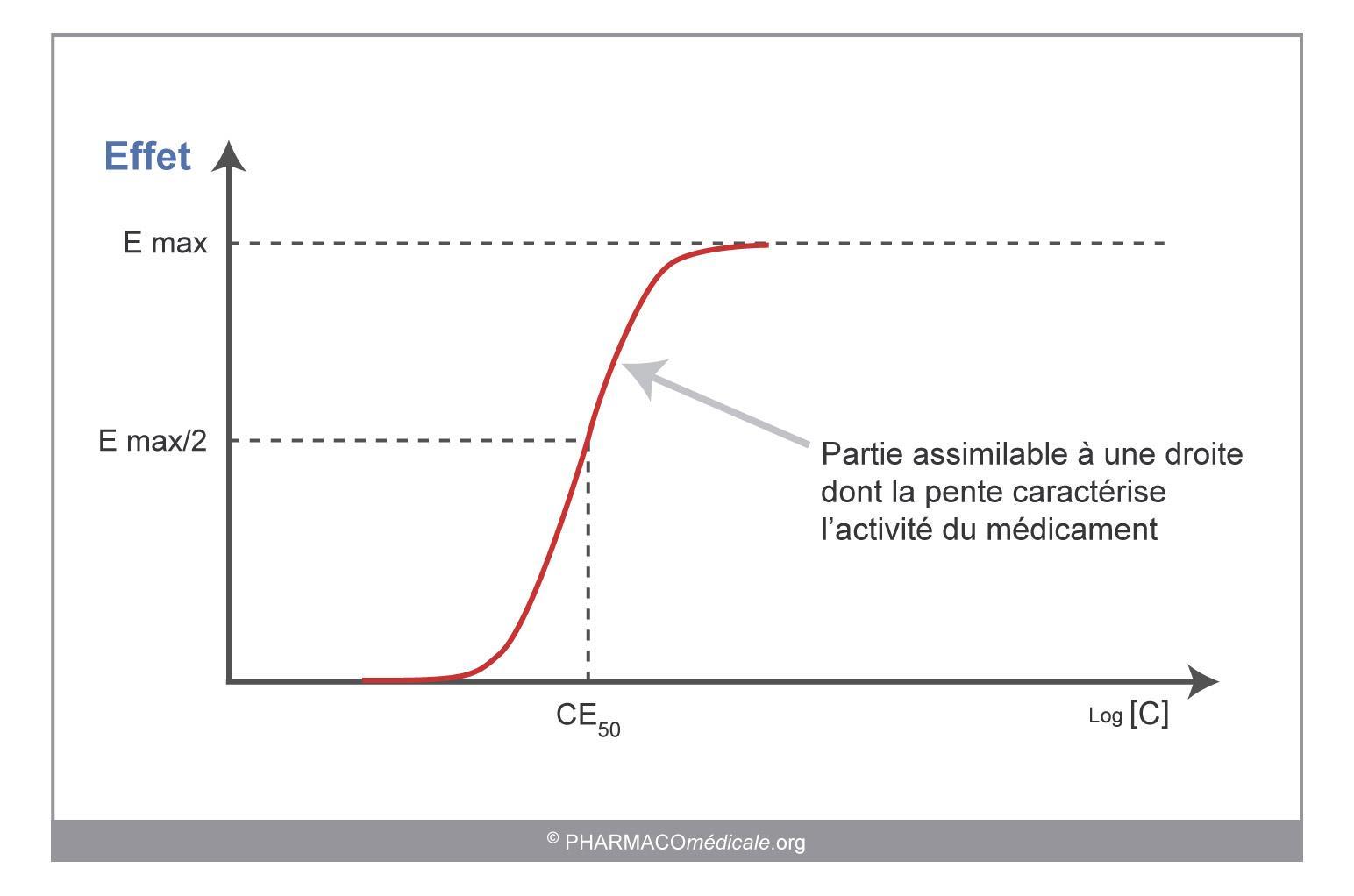
La représentation graphique (figure 2) de l’évolution de l’effet en fonction du logarithme de la concentration est une courbe appelée sigmoïde (la relation est une hyperbole lorsque l’effet est exprimé en fonction de la concentration – et non de son logarithme).
La partie médiane de la sigmoïde peut être assimilée à une droite dont la pente est l'une des caractéristiques de l'activité de la molécule, le plateau représente l'effet maximum : Emax, pouvant être obtenu.
La concentration entraînant 50 % de l'effet maximum définie la concentration efficace 50 : CE 50. Cette CE50 caractérise la puissance de la molécule
La relation concentration - effet d’un agoniste est définie par la puissance, la pente et le Emax.
- Dernière mise à jour le .











