L’absorption correspond à l’ensemble des phénomènes intervenant dans le transfert du principe actif médicamenteux depuis son site d’administration jusqu’à la circulation sanguine. Cette étape du devenir du médicament chez l’homme est essentielle à étudier car elle peut être à l’origine d’une variabilité importante de la réponse aux médicaments notamment par le biais d’interactions médicamenteuses significatives.
1. Les différentes voies d'administration
Plusieurs voies d’administration sont possibles (figure 1) :
• Par voie générale ou systémique :
- intra-veineuse et intra-artérielle
- sous-cutanée et intra-musculaire
- nasale, sub-linguale, orale (ou per os), rectale
• Par voie locale ou in situ :
- inhalée, oculaire et intra-oculaire, cutanée ou transdermique
- intra-articulaire et intra-thécale
Le choix de la voie d'administration dépend de l’objectif thérapeutique (rapidité d’effet, limitation des effets systémiques), des possibilités d'administration chez le malade, des propriétés physico-chimiques et de la taille des molécules (résistance à l’acidité gastrique et aux enzymes digestives, facilité à passer les barrières capillaires ou digestives …) et des processus d’élimination de ces médicaments (biotransformation intestinale, hépatique).
Par voie générale, on peut distinguer de façon simple 2 types de voies d’administration, d’une part les voies d’administration où le médicament rejoint la circulation générale soit directement soit au travers de la paroi capillaire et les voies d’administration où les médicaments rejoignent la circulation générale au travers de la barrière digestive puis par le système porte et donc un premier passage obligé par le foie.

Figure n°2. Différentes voies d'administration des médicaments
- Voie intra-veineuse
La voie intra-veineuse représente la voie d’administration de référence pour l'absorption dans la mesure où le médicament atteint directement la circulation générale. L’absorption est complète et rapide, le seul facteur limitant étant la vitesse d’administration du médicament.
- Voies sous-cutanée et intra-musculaire
Les voies d’administration sous-cutanée et intra-musculaire imposent aux médicaments de franchir la barrière capillaire. Par ces voies, le médicament atteint la circulation générale sans passage obligé par le système porte et le foie. L’absorption sera plus ou moins complète et plus ou moins rapide en fonction des propriétés physico-chimiques des médicaments.
- Voie orale ou per os
La voie d’administration orale ou per os impose au médicament un passage au travers de la barrière digestive puis le passage de la paroi capillaire. Ce passage peut se faire par simple diffusion passive ou faire intervenir des phénomènes plus complexes avec mise en jeu d’un système de transporteurs favorisant ou au contraire limitant l’absorption.
Enfin, les cellules intestinales (entérocytes) sont pourvues de systèmes enzymatiques et le médicament peut subir à ce niveau des biotransformations, le médicament étant détruit avant même d’atteindre le compartiment sanguin.
Une fois la barrière digestive franchie, pour rejoindre la circulation générale le médicament doit passer par le système porte et le foie où il peut subir des biotransformations par les systèmes enzymatiques des hépatocytes. Le métabolisme des médicaments peut être, dans certains cas, suffisamment important pour que la quantité de médicament atteignant la circulation générale soit réduite de façon significative. On parle alors d’effet de premier passage hépatique (EPPh) (ex: propranolol).
- Voie rectale
Cette voie présente les mêmes caractéristiques que la voie orale mais elle permet d’éviter en partie un éventuel effet de premier passage hépatique dans la mesure où les veines hémorroïdales inférieures et moyennes ne rejoignent pas le système porte.
- Voies sub-linguale et nasale
Ces 2 voies permettent également une absorption très rapide et sans effet de premier passage hépatique : les médicaments, une fois la paroi capillaire franchie, atteignent directement la circulation générale.
- Administrations locales
Ces voies sont surtout utilisées lorsqu’on veut obtenir un effet rapide et/ou éviter un effet systémique (passage dans la circulation générale). Toutefois un passage systémique du médicament est toujours possible.
2. Principes généraux de l'absorption
Le médicament doit d’abord être mis en solution afin de franchir les membranes, particulièrement pour les médicaments administrés par voie orale. Pour cette raison, on distingue classiquement, dans les mécanismes d’absorption, les deux étapes suivantes :
• Une étape de libération ou dissolution
• Une étape de résorption
Ces deux étapes sont aussi importantes l’une que l’autre dans la mesure ou elles vont pouvoir être un facteur limitant de la vitesse et de la quantité de médicament qui atteindra la circulation systémique après administration.
La libération correspond à la désintégration de la forme solide de la molécule (comprimé, gélule, poudre, dragée, cristaux...) en une forme résorbable par l’organisme. On peut alors contrôler, par le choix d’un mode de fabrication approprié, la durée de la libération du principe actif, le lieu et la vitesse de l’absorption. La modification de la formulation galénique d’un médicament peut ralentir l’absorption avec une mise en solution lente, et ainsi permettre de prolonger l’effet du médicament dans le temps (formes « retard ») et/ou de réduire le nombre de prises quotidiennes et/ou d’éviter les effets de pic de concentration (voir influence des formes et voies d'administration). Par exemple, on peut fabriquer des formes à libération prolongée : la substance active est alors enfermée dans une trame qui permet une diffusion progressive et donc une résorption tout au long du tractus digestif. Il existe également des formes à libération retardée : pour protéger les substances détruites en milieu acide, on peut élaborer des comprimés entourés de pellicules gastrorésistantes, résistants ainsi à la désintégration par les sucs gastriques. La libération n’est pas prolongée mais seulement déplacée, et la résorption se fera essentiellement au niveau intestinal.
La résorption, quant à elle, n’intervient qu’une fois la libération et la mise en solution obtenue.
3. Mécanismes de résorption par voie orale
Tous les mécanismes impliqués dans l’absorption des médicaments sont mis en jeu au cours d’une administration par voie orale. Aussi, cette voie d’administration sera principalement détaillée dans ce chapitre.
Une fois le médicament administré, il doit pouvoir se dissoudre dans le milieu gastro-intestinal et ne pas être détruit par l’acidité des sécrétions gastriques ou par les enzymes contenues dans la lumière intestinale. La dissolution du médicament se fait plus ou moins rapidement selon l’hydrosolubilité des médicaments et la formulation galénique. Une fois cette dissolution obtenue, le médicament passe la barrière digestive principalement par diffusion passive ou par phénomène de transport actif.
- Diffusion passive
Pour diffuser passivement à travers la membrane gastro-intestinale, membrane de nature lipidique, les molécules doivent être liposolubles et non ionisées. Aussi la vitesse de diffusion des substances médicamenteuses dépend essentiellement de la concentration de la forme non ionisée du médicament et de sa liposolubilité.
Les médicaments sont le plus souvent des bases faibles, plus rarement des acides faibles. Ces médicaments existent donc sous 2 formes, ionisée et non ionisée, or seule cette dernière franchit les membranes. La concentration de la forme non ionisée dépend du pKa du médicament et du pH du milieu dans lequel il se trouve. Un acide faible se trouvera essentiellement sous forme non ionisée en milieu acide et son absorption sera favorisée dans l’estomac. A l’inverse une base faible, très fortement ionisée en milieu acide, ne sera pas absorbée au niveau de l’estomac mais sera absorbée au niveau intestinal où le pH est plus élevé.
Ce processus va dans le sens d’un gradient de concentration, il ne consomme donc pas d’énergie. Il n’est pas spécifique d’un médicament, n’est pas saturable et il n’existe pas de phénomène de compétition. Il dépend bien évidemment de la masse molaire de la substance médicamenteuse, les molécules de grande taille (>1000 Da) étant moins bien absorbées que les petites molécules.
- Transport actif
Ce phénomène correspond au passage du médicament à travers la membrane gastro-intestinale contre un gradient de concentration après formation d’un complexe du médicament avec un transporteur membranaire. Ce mécanisme est spécifique, saturable et peut subir des phénomènes de compétition. Ce processus peut être inhibé ou induit par d’autres substances médicamenteuses. Ces phénomènes d’interactions médicamenteuses peuvent donc être à l’origine d’une variation plus ou moins importante de la quantité de médicament absorbée.
Parmi l’ensemble des transporteurs de la barrière intestinale, la P–Glycoprotéine (P-gp), semble être au premier plan dans la limitation de l’absorption des médicaments, comme par exemple pour les inhibiteurs des protéases et les statines.
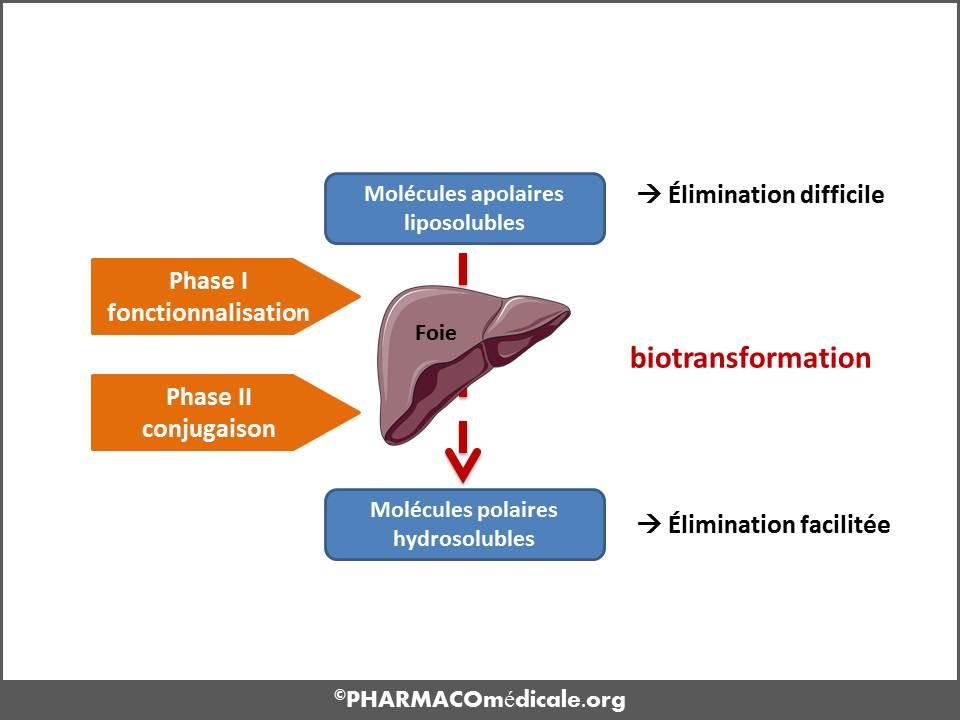
Bio-transformation intestinale et hépatique: effets de premier passage
Les entérocytes et les hépatocytes sont pourvus de nombreuses enzymes de phase I (cytochromes P450) et de phase II (conjugaisons). Ces mécanismes de biotransformation sont détaillés dans le chapitre biotransformation. Ces réactions enzymatiques peuvent parfois être suffisamment importantes pour limiter l’absorption du médicament lors de son passage au travers des entérocytes avec un effet de premier passage (EPP) intestinal. Une fois que le médicament a atteint le système veineux porte, il peut subir une biotransformation par les systèmes enzymatiques des hépatocytes. Là encore la fraction de médicament biotransformée lors de ce premier passage au niveau du foie peut être suffisamment importante pour réduire encore la fraction absorbée : on parle d’effet de premier passage (EPP) hépatique. Cet EPP n’est pas toujours négatif notamment dans le cadre de « prodrogues », médicaments inactifs qui deviennent actifs au cours des biotransformations qu’il subit lors de l’EPP.
- Facteurs de variabilité de l’absorption par voie orale
Au total la quantité de médicament absorbée va dépendre (figure 2) :
• De ses propriétés physico-chimiques : liposolubilité (coefficient de partage, Log P), son degré d'ionisation (constante d'ionisation, pKa), taille (masse moléculaire)
• De la forme galénique du médicament : la vitesse de libération du principe actif et le lieu de la résorption dépendent de la forme galénique (comprimés à libération prolongée, gastrorésistants...)
• De l’activité enzymatique des entérocytes et des hépatocytes et des systèmes transporteurs entérocytaires (interactions médicamenteuses éventuelles)
• Du patient lui-même avec tous les facteurs affectant le pH gastrique, la vidange gastrique et la motilité intestinale, que ces facteurs soient physiologiques (âge, alimentation…), pathologiques (digestives ou hémodynamiques) ou médicamenteux
Les autres voies d’administrations répondent aux mêmes mécanismes d’absorption que la voie orale en dehors de l’effet de premier passage hépatique et intestinal.

Figure n°3 : résorption par voie orale
4. Paramètres résumant l'absorption
- Notion de biodisponibilté
La biodisponibilité (F) d’un médicament est définie comme la fraction de la dose administrée ou du principe actif libéré par la forme pharmaceutique qui parvient sous forme inchangée dans la circulation sanguine systémique et la vitesse à laquelle se réalise ce processus. Lorsque l’administration se fait par voie intraveineuse, aucun doute sur la quantité de médicament ayant atteint la circulation sanguine : on dit que la biodisponibilité est de 100%.
Pour toutes les autres voies d’administration, la biodisponibilité peut être incomplète en raison des phénomènes suivants (Figure 2) :
• Absorption (incluant les caractéristiques physico-chimiques des médicaments, la physiopathologie : condition circulatoire sanguine au site d’administration, vitesse de transit intestinal, composition du milieu intestinal (enzymes, pH…))
• Effet de premier passage (intestinal, hépatique ou pulmonaire...)
La biodisponibilité d’un médicament (F) peut se calculer simplement par comparaison de l’aire sous la courbe (ASC) des concentrations plasmatiques en fonction du temps obtenue par la voie d’administration considérée par rapport à l’ASC obtenue avec une administration IV. Par exemple pour une administration per os :
F = [ dose IV x ASC orale ] / [ dose orale x ASC IV ]
La vitesse à laquelle le médicament est résorbé est également un paramètre important de l’absorption pour toutes les voies d’administration autres que la voie intra-veineuse. En effet de cette vitesse dépendra le délai d’apparition des effets des médicaments qu’il s’agisse des effets thérapeutiques ou indésirables. Le paramètre permettant d'évaluer la vitesse de l'absorption est le Tmax, c'est à dire le temps nécessaire pour atteindre la concentration sanguine maximale (Cmax).
Des modifications galéniques sont parfois utilisées pour ralentir la vitesse d’absorption soit afin d’éviter l’apparition d’effets indésirables éventuellement associés à une apparition trop rapide et trop importante du médicament, soit afin de réduire la fréquence d'administration du médicament.
Cette vitesse d’absorption peut être exprimée en demi-vie d’absorption définie par le temps qu’il faut pour que la moitié du médicament soit absorbée. Elle correspond à l’inverse de la pente d’apparition des concentrations plasmatiques.
Risques d'interactions médicamenteuses
Il conviendra d'être particulièrement vigilant lors de la manipulation de médicaments possédant une faible biodisponibilité. Certains médicament ont en effet une biodisponibilité faible après administration par voie orale, essentiellement en raison d'un effet de premier passage hépatique ou intestinal. C'est notamment le cas du tacrolimus (F = 20-25%), du vérapamil (F = 20-30%) ou de la felodipine (F = 15%). En cas d'interaction médicamenteuse, l'exposition de l'organisme à ces médicaments pourra varier de manière très importante. Par exemple la consommation de jus de pamplemousse (inhibiteur des CYP3A4) augmente d'un facteur 3 l'absorption de la felodipine par inhibition des cytochrome intestinaux : sa biodisponibilité passe de 15 à 45%, ce qui peut être à l'origine d'un surdosage. Ce risque d'interaction médicamenteuse avec des inhibiteurs enzymatiques sera beaucoup plus faible avec les médicaments possédant une biodisponibilité élevée, puisque la variation de l'exposition sera bien moindre (ex : une biodisponibilité passant de 90 à 95% aura peu de répercussions).