*Antibiotiques : Les points essentiels
Résumé de la fiche
Depuis l’utilisation historique du sulfanilamide puis de la pénicilline chez l’homme au cours de la première moitié du 20ème siècle, les preuves de l’efficacité des antibiotiques dans le traitement des maladies infectieuses ont été largement établies.
Substances organiques naturelles ou synthétiques, les antibiotiques se définissent par leur aptitude à limiter la multiplication des bactéries pathogènes, les plus puissants pouvant même éradiquer l’inoculum bactérien.
Pour être efficace, un antibiotique doit rencontrer sa cible ou son point d’impact. Si cette cible n’existe pas, le germe est insensible à l’antibiotique, définissant la résistance naturelle ou intrinsèque liée à l’équipement génétique bactérien. Si cette cible est présente mais rendue inaccessible par différents mécanismes, le germe devient insensible à l’antibiotique, définissant la résistance acquise.
Une antibiothérapie bien conduite et justifiée exige une réflexion préalable intégrant des paramètres microbiologiques, pharmacologiques et cliniques afin de définir les modalités pratiques de sa mise en œuvre (monothérapie ou association, posologie et modalités d’administration, durée du traitement).
Les antibiotiques ont incontestablement fait reculer la mortalité liée aux maladies infectieuses. Dans le même temps cependant, le nombre trop important de prescriptions inadaptées nourrit une difficile réflexion de santé publique avec un volet économique certes, en termes de dépenses pharmaceutiques, mais aussi et surtout un volet écologique, par l’émergence de bactéries devenues résistantes aux antibiotiques, ce qui oblige à la découverte de molécules nouvelles.
Dès lors, de gros efforts pédagogiques en infectiologie sont nécessaires pour promouvoir et faire respecter les recommandations portant sur le bon usage des antibiotiques.
Item(s) ECN
177 (R2C) : Prescription et surveillance des anti-infectieux chez l’adulte et l’enfant330 (R2C) : Prescription et surveillance des classes de médicaments les plus courantes chez l’adulte et chez l’enfant
Rappel physiopathologique
- Une infection se définit par l’entrée et la multiplication d’un agent pathogène dans l’organisme.
Le temps séparant l’exposition à l’agent infectieux des premiers symptômes, souvent peu spécifiques comme la fièvre ou la fatigue, constitue la période d’incubation.
Puis, apparaissent les signes cliniques caractéristiques de l’infection en cours dont le développement et la sévérité dépendront de l’équilibre existant entre virulence de l’agent pathogène et efficacité des défenses immunitaires de l’hôte.
Si la croissance du germe infectieux est rapidement jugulée, la maladie reste asymptomatique et passe totalement inaperçue. Inversement, si la charge bactérienne échappe aux défenses immunitaires, la maladie s’installe et requiert un traitement anti-infectieux adapté.
- Les mécanismes responsables du pouvoir pathogène microbien sont multiples.
On trouve des enzymes désorganisant les matrices cellulaires comme la hyaluronidase (streptocoque), la collagénase (clostridium), les lécithinases et les protéases, ceci facilitant la dissémination bactérienne.
Les germes pyogènes, comme le staphylocoque doré, possèdent une ou plusieurs coagulases accélérant la formation de caillots de fibrine dans un contexte de nécrose tissulaire plus ou moins purulente.
Les effets à distance sont dus aux toxines bactériennes :
- Ainsi, l’endotoxine, fraction lipidique du lipopolysaccharide de la paroi des germes Gram négatif, est un inducteur puissant des cytokines de l’inflammation comme l’interleukine-1 ou le TNF (tumor necrosis factor) expliquant l’effet pyrogène et favorisant le choc septique.
- Les nombreuses exotoxines, plus fréquemment sécrétées par les bactéries Gram positif, sont des protéines spécifiques cytotoxiques, neurotoxiques ou entérotoxiques.
- Pour échapper aux défenses immunitaires, certains germes possèdent une capsule à base de glycocalix inhibant la phagocytose (pneumocoque, haemophilus, klebsiella, cryptococcus), d’autres sécrètent hémolysines et leucocidines pour lyser les cellules sanguines (staphylocoques et streptocoques).
Parfois aussi, la réponse immunitaire est exacerbée, à l’origine d’une pathologie inflammatoire surajoutée.
Présentation des principaux germes pathogènes chez l’homme
|
Germes |
Maladies infectieuses |
Habitat principal |
|
Bacilles Gram + |
|
|
|
Bacilles Gram - |
|
|
|
Cocci Gram + |
|
|
|
Cocci Gram - |
|
|
|
Bactéries anaérobies |
|
|
Médicaments existants
Le nombre de spécialités antibiotiques disponibles sur le marché pharmaceutique français est particulièrement élevé, témoin des enjeux économiques soulevés par cette classe thérapeutique. Le tableau suivant les présente par familles pharmacologiques ayant une structure chimique commune. D’autres classifications existent, davantage microbiologiques comme celles basées sur le spectre d’action (exemple : espèces sensibles, espèces modérément sensibles ou espèces résistantes) ou sur le mécanisme d’action (cibles moléculaires bactériennes) ou davantage pharmacodynamiques comme celles comparant le mode de bactéricidie in vitro selon qu’il s’exprime en fonction de la concentration atteinte ou en fonction du temps de contact avec la bactérie.
Présentation pharmacologique des différentes classes d’antibiotiques par structure chimique commune
|
ß-LACTAMINES |
||
|
Pénicillines G et V, sensibles aux pénicillinases |
Céphalosporines de 1ère génération (C1G) |
Céphalosporines de 3ème génération (C3G) |
|
Benzylpénicilline (im, iv) Phénoxyméthylpénicilline (vo) |
Céfaclor (vo) Céfadroxil (vo) Céfalexine (vo) Céfalotine (im, iv) Céfapirine (im, iv) Céfatrizine (vo) Céfazoline (im, iv) Céfradine (vo) |
Céfixime (vo) Céfopérazone (im, iv) Céfotaxime (im, iv) Céfotétan (im, iv) Céfotiam (vo) Cefpirome (iv) Cefpodoxime (vo) Cefsulodine (im, iv) Ceftazidime (im, iv) Ceftazidime + avibactam (iv) Ceftizoxime (im, iv) Ceftriaxone (im, iv) Cetozolane + Tazobactam (iv) |
|
Pénicillines M, résistantes aux pénicillinases |
Céphalosporines de 2ème génération (C2G) |
Autres ß-lactamines |
|
Cloxacilline (vo, im, iv) Oxacilline (vo, im, iv) |
Céfamandole (im, iv) Céfoxitine (iv) Céfuroxime (vo, im, iv) |
Aztréonam (im, iv) |
| Céphalosporines de 4ème génération | Céphalosporines de 5ème génération | Carbapénèmes |
|
Céfépime (im, iv) |
Ceftobiprole (iv) Céfidérocol (iv) Ceftaroline (iv) |
Imipénem + cilastatine (iv) Imipénem + cilastatine + relebactam (iv) Méropénem (iv) Ertapénem (iv) Doripénem (iv) |
|
Pénicillines A (spectre élargi) |
Pénicillines antipyocyaniques |
ANTI-STAPHYLOCOCCIQUES Glycopeptides et divers |
|
Amoxicilline (vo, im, iv) Amoxicilline + acide clavulanique (vo, iv)) Ampicilline (vo, im, iv) Ampicilline + sulbactam (im, iv) Bacampicilline (vo) Pivampicilline (vo) |
Ticarcilline (im, iv) Ticarcilline + acide clavulanique (iv) Mezlocilline (iv) Pipéracilline (im, iv) Pipéracilline + tazobactam (iv) |
Téicoplanine (im, iv) Vancomycine (vo, iv) Acide fusidique (vo, iv) Fosfomycine (iv) Dalbavancine (iv) |
|
AMINOSIDES |
FLUOROQUINOLONES |
MACROLIDES et apparentés |
|
Amikacine (im, iv) Gentamicine (im, iv) Isépamicine (im, iv) Nétilmicine (im, iv) Spectinomycine (im, iv) Tobramycine (im, iv) |
Ciprofloxacine (vo, iv) Lévofloxacine (vo, iv) Moxifloxacine (vo) Ofloxacine (vo, iv) Péfloxacine (iv) Délafloxacine (vo, iv) |
Azithromycine (vo) Clarithromycine (vo) Dirithromycine (vo) Erythromycine (vo, iv) Josamycine (vo) Midécamycine (vo) Roxythromycine (vo) Spiramycine (vo, iv) Clindamycine (vo, im, iv) Lincomycine (vo, im, iv) Pristinamycine (vo) Quinupristine + dalfopristine (iv) Télithromycine (vo) |
|
CYCLINES |
IMIDAZOLES |
|
|
Doxycycline (vo, iv) Lymécycline (vo) Métacycline (vo) Minocycline (vo) Oxytétracycline (vo) |
Métronidazole (vo, iv) Ornidazole (iv) Tinidazole (vo) |
|
|
SULFAMIDES |
DIVERS |
ANTITUBERCULEUX |
|
Sulfadiazine (vo) Sulfaméthoxazole +Triméthoprime ou Cotrimoxazole (vo, iv) |
Thiamphénicol (im, iv) Colistine (im, iv) Linézolide (vo, iv) |
Ethambutol (vo); Isoniazide (vo, im, iv) ; Pyrazinamide (vo); Rifabutine (vo); Rifampicine (vo, iv) ; Streptomycine (im, iv) |
vo: voie orale ; im : voie intramusculaire ; iv = voie intraveineuse
Mécanismes d’action des différentes molécules
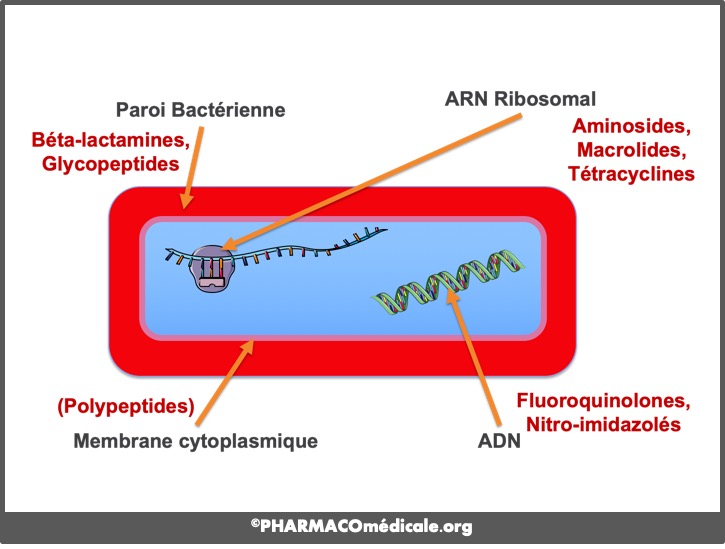
Par définition, le mécanisme de l’action antibiotique implique une ou plusieurs cibles moléculaires spécifiques au monde bactérien conférant à cette classe de médicaments une marge de sécurité relativement large. On décrit très classiquement les 4 points d’impact suivants :
- (1) Paroi bactérienne : ß-lactamines, glycopeptides, fosfomycine, cyclosérine, bacitracine perturbent la biosynthèse du peptidoglycane, glycoprotéine complexe de la paroi, induisant la perte de la viabilité cellulaire, voire la lyse de la cellule bactérienne. L’isoniazide, l’éthambutol et le pyrazinamide, 3 antituberculeux, agissent également sur des cibles de la paroi de Mycobacterium tuberculosis impliquant le métabolisme des acides mycoliques ;
- (2) Synthèse protéique : le ribosome bactérien est la cible supramoléculaire de nombreux antibiotiques, provoquant l’arrêt plus ou moins brutal de la synthèse protéique. On citera l’inhibition des liaisons peptidiques par les phénicolés ; l’inhibition de l’élongation protéique par les aminosides et les tétracyclines ; l’inhibition de la translocation par les macrolides et apparentés (lincosamides, streptogramines ou synergistines, kétolides), le linézolide et les everninomycines ; l’inhibition des étapes post-translocation par l’acide fusidique ;
- (3) Génome bactérien : de nombreuses erreurs dans la synthèse de l’ADN bactérien s’obtiennent par l’inhibition de l’ARN-polymérase avec les rifamycines, l’inhibition de l’ADN-gyrase avec les fluoroquinolones, ou par l’inhibition de la synthèse des purines par les sulfamides et le cotrimoxazole. Nitro-imidazolés et nitrofuranes agissent également sur le génome bactérien selon des mécanismes moins bien connus ;
- (4) Membrane interne : en dénaturant les phospholipides de la membrane interne, les agents polycationiques (polymyxines, colistine) ou polyéniques (nystatine, amphotéricine B) provoquent la fuite fatale de composés intracellulaires par rupture de la perméabilité cellulaire.
fig. 1 : points d'impact des antibiotiques sur les bactéries
Effets utiles en clinique
Le succès d’une antibiothérapie, qu’elle soit curative ou prophylactique, dépend d’un ensemble de règles qu’il faut à la fois bien connaître et bien respecter.
L’antibiothérapie curative s’adresse au patient déjà infecté.
Idéalement, le choix antibiotique à entreprendre devrait attendre le diagnostic formel du caractère infectieux de la maladie par l’isolement puis la caractérisation de l’agent causal.
En pratique courante, cette documentation fait souvent défaut, de sorte que la prescription antibiotique s’opère sur un mode probabiliste reposant sur la conviction que le tableau clinique du patient dépend d’un processus infectieux impliquant plus probablement une certaine espèce bactérienne.
Ceci permet un choix rationnel parmi les antibiotiques considérés efficaces contre le germe supposé.
Cette prescription probabiliste, aussi appelée empirique, ne doit donc rien au hasard car elle se fonde sur une démarche réfléchie et argumentée.
La présente les principales maladies infectieuses avec les propositions antibiotiques les plus couramment recommandées.
Parfois, la documentation bactériologique de l’infection (ECBU, hémocultures, ponction pleurale, LCR, par exemple) s’impose, soit d’emblée, soit rapidement après l’instauration de l’antibiothérapie probabiliste.
Cette démarche assure une prescription curative adaptée à la sensibilité du germe in vitro, faisant correspondre au mieux les paramètres pharmacodynamiques et pharmacocinétiques des antibiotiques retenus aux paramètres du terrain (âge, localisation de l’infection, fonctions rénale et hépatique).
L’antibioprophylaxie s’adresse à un patient particulier, a priori indemne de toute infection, mais devant subir un geste médical ou chirurgical indispensable qui, chez lui, présente un haut risque infectieux local ou général.
L’antibioprophylaxie, par nature probabiliste, doit précéder ce geste médical ou chirurgical et elle ne peut être que de courte durée.
Pharmacodynamie des effets utiles en clinique
La pharmacodynamie des antibiotiques repose sur une base microbiologique fondamentale mesurant in vitro et pour chaque couple germe-antibiotique les index suivants :
- CMI, concentration minimale inhibitrice, plus faible concentration d’antibiotique inhibant la croissance bactérienne. Index de sensibilité bactérienne, la CMI peut révéler la présence d’une résistance au moyen de l’antibiogramme, mesure sandardisée et automatisable de la sensibilité, établissant le spectre de l’antibiotique sous la forme d’un classement des germes en espèces sensibles, intermédiaires (ou modérément sensibles) et résistantes en fonction de valeurs critiques intégrant des données pharmacocinétiques.
- CMB, concentration minimale bactéricide, plus faible concentration d’antibiotique qui, agissant sur un inoculum initial, ne laisse qu’un faible pourcentage de bactéries survivantes (0.1% ou 0.01% selon le cas, après 18 à 24 heures de contact). Index de puissance antibiotique, la CMB s’évalue aussi de manière dynamique au moyen des courbes de bactéricidie qui décrivent la décroissance de l’inoculum dans le temps en fonction de différentes concentrations de l’antibiotique. La phase précoce de la courbe (6-8 premières heures) distingue les antibiotiques dits « concentration-dépendants » à effet bactéricide puissant et rapide dépendant principalement de la concentration, des antibiotiques dits « temps-dépendants » à effet bactéricide lent et souvent moins marqué dépendant principalement du temps de contact avec le germe.
|
Antibiotiques à effet bactéricide |
Antibiotiques à effet bactéricide |
|
Aminosides |
ß-lactamines sur bacilles Gram moins |
|
Fluoroquinolones sur bacilles Gram moins |
Fluoroquinolones sur Gram plus |
|
ß-lactamines sur germes Gram plus |
Glycopeptides |
|
Fosfomycine sur bacilles Gram moins |
Macrolides |
|
Métronidazole sur les anaérobies |
Sulfamides |
|
Tétracyclines |
Caractéristiques pharmacocinétiques utiles en clinique
Pour être efficace, un antibiotique doit rencontrer le germe au site même du foyer infectieux. Or, la pénétration tissulaire dépend non seulement du tissu infecté mais aussi du schéma posologique retenu. Quand elles sont disponibles, les données cinétiques tissulaires permettent d’établir les modalités d’administration offrant la meilleure adéquation possible entre profils pharmacocinétiques et modes de bactéricidie in vitro, tout en intégrant l’éventualité d’un EPA
|
Paramètres étudiés |
Bactéricidie concentration-dépendante |
Bactéricidie temps-dépendante |
|
Efficacité maximale |
Concentration la plus élevée possible |
Concentration supérieure au seuil d’efficacité |
|
Vitesse de bactéricidie |
Rapide (d’autant plus que la concentration est élevée) |
Lente (et indépendante de la concentration) |
|
Effet post-antibiotique |
Prolongé in vivo |
Absent ou court, sauf exception |
|
Recroissance bactérienne secondaire |
Retardée par l’existence d’un EPA |
Effective dès que la concentration descend sous le seuil d’efficacité |
|
Schéma posologique à favoriser |
Administration rapide de fortes doses (si la tolérance le permet) |
Maintien de concentrations efficaces (ex : perfusion continue) |
|
Intervalle d’administration |
Allongé, par rapport à celui suggéré a priori par la demi-vie d’élimination |
Etabli selon le seuil d’efficacité, la dose et la demi-vie d’élimination |
|
Critères d’efficacité |
Cmax, Cres |
Cres |
|
Adaptation de posologie |
Priorité à l’allongement de l’intervalle de prise |
Priorité à la diminution de la dose |
Repris et adapté de : Pharmacodynamie des antibiotiques, O. Petitjean, P. Nicolas, M. Tod, pages 13 – 81. In : Infections et antibiothérapie en réanimation aux urgences et en chirurgie , C. Martin et F. Gouin, 2ème édition, Arnette, 2000.
fig. 2 : critères pharmacocinético-pharmacodynamiques d’évaluation

Source de la variabilité de la réponse
En dehors du phénomène de la résistance bactérienne, de nombreux facteurs sont susceptibles d'influencer la réponse antibiotique, leur effet combiné pouvant même provoquer l’échec thérapeutique. Nous citerons principalement :
- L’effet inoculum :
On appelle inoculum la quantité de bactéries présentes à l'instauration du traitement. Quand ce nombre est élevé (> 108 cfu/ml, cas des collections suppurées par exemple), on observe une élévation franche des CMI des ß-lactamines et des glycopeptides. En revanche, aminosides et fluoroquinolones sont généralement peu influencés par l'effet inoculum;
- L’état métabolique :
Habituellement, la bactéricidie est maximale quand les germes sont en phase de croissance rapide. Si les ressources nutritives s'avèrent localement insuffisantes, la croissance bactérienne se ralentit, approchant parfois l'état stationnaire, ce qui diminue d'autant et principalement l'efficacité des antibiotiques "temps-dépendants";
- L’adhésion bactérienne :
Provoquée par la synthèse du glycocalix ou "slime", exopolysaccharide formant une coque autour des bactéries, ce qui les protège de la phagocytose et de la pénétration antibiotique puisque les concentrations efficaces s’avèrent très largement supérieures aux CMI habituelles. Ce phénomène est très fréquent lors des infections sur corps étrangers (prothèses, valves cardiaques artificielles, …), la relative inefficacité des antibiotiques imposant alors très souvent un geste chirurgical associé;
- L’acidose et l’anaérobiose du tissu infecté :
Tout abaissement local du pH et/ou de la pO2 augmentent significativement les CMI des aminosides, des fluoroquinones et des macrolides. Ces conditions défavorables expliquent souvent les échecs des traitements des infections ostéoarticulaires ;
- Les inhibiteurs endogènes :
La purulence des expectorations ou des abcès contient de nombreux produits de dégradation cellulaire (fragments d’acides nucléiques, ions divalents Calcium, Magnésium, …) qui peuvent fixer et inactiver aminosides et polymyxines, et à un degré moindre les fluoroquinolones
Situations à risque ou déconseillées
Les antibiotiques possèdent, globalement, une excellente marge thérapeutique. Les réactions d’hypersensibilité, éventuellement croisées entre les deux familles de ß-lactamines (pénicillines et céphalosporines), constituent la contre-indication la plus fréquente, toutes classes confondues. Quelques situations spécifiques, rapportées dan le tableau suivant, sont aussi à connaître afin d'éviter une prescription antibiotique inadaptée exposant à un risque toxique parfois grave :
|
Classes |
Contre-indications |
Contre-indications relatives ou précautions d’emploi |
|
ß-lactamines |
Hypersensibilité |
Selon le cas : infections par les herpés virus (MNI) |
|
Aminosides |
Hypersensibilité |
Grossesse : toxicité cochléovestibulaire du fœtus ; Ototoxicité ; Néphrotoxicité |
|
Fluoroquinolones |
Antécédents de tendinopathie |
Enfant jusqu’à la période de croissance (toxicité articulaire) ; |
|
Macrolides et |
Hypersensibilité |
• selon le cas: allongement de l’espace QT ; IH sévère |
|
Tétracyclines |
Hypersensibilité |
• doxycycline : ulcérations de l’œsophage |
|
Phénicolés |
Hypersensibilité; Antécédents d’insuffisance médullaire ; |
Grossesse : atteinte des lignées médullaires et risque de syndrome gris du nouveau-né |
|
Sulfamides |
Allaitement ; Déficit en G6PD ; Hypersensibilité ; IH sévère ; nouveau-né < 1 mois |
Grossesse : immaturité des fonctions enzymatiques hépatiques et risque d’ictère nucléaire |
Précautions d’emploi
Certains états ou situations physiopathologiques particulières imposent le respect de précautions d'emploi spécifiques, comme :
- sujet insuffisant rénal (IR) :
aminosides, glycopeptides, polymyxines, fluoroquinolones et à un degré moindre, quelques ß-lactamines nécessitent une adaptation de posologie, dès que la clairance de la créatinine s'abaisse au dessous de 50 ml/min;
- sujet insuffisant hépatique (IH) :
en l'absence de tout critère simple permettant d'adapter les posologies au degré d'IH, l'attitude reste pragmatique. Aminosides (index thérapeutique étroit), isoniazide, pyrazinamide, téicoplanine et nitrofurantoïne (risque de cytolyse), sulfamides, macrolides, fluoroquinolones et rifampicine (risque de cholestase), figurent parmi les antibiotiques à surveiller;
- patient de réanimation, patient polytraumatisé, grand brûlé :
toutes situations où les perturbations hémodynamiques induisent une augmentation du volume de distribution des antibiotiques hydrosolubles (ex : aminosides, ß-lactamines, glycopeptides). Il faut, très souvent, augmenter les doses du fait, soit des déficits d'apport (moindre débit de perfusion sanguine), soit de la forte dilution locale liée aux oedèmes;
- grossesse : une infection maternelle pendant la grossesse pose, notamment, la question du risque fœtal. ß-lactamines et macrolides sont utilisés en première intention. Aminosides, glycopeptides, fluoroquinolones s'utiliseront avec forte prudence. Cyclines, phénicolés et sulfamides sont, a priori, contre-indiqués;
- allaitement : seules les ß-lactamines offrent une sécurité suffisante. Les autres classes méritent réflexion mais classiquement, phénicolés, cyclines, sulfamides, fluoroquinolones, glycopeptides et lincosamides sont contre-indiqués;
- polythérapie : les interactions médicamenteuses au cours des traitements anti-infectieux concernent la majorité des classes antibiotiques. Parmi les plus pertinentes, citons la moindre biodisponibilité des tétracyclines, fluoroquinolones et de la rifampicine en présence des cations métalliques des pansements gastriques (Fe2+, Zn2+, Al3+, Mg2+, Ca2+), la majoration des effets anticoagulants (coumarine) et hypoglycémiants (tolbutamide) en présence de sulfamides, et les nombreuses interactions impliquant macrolides, fluoroquinolones et antifongique azolés, en raison de leur potentiel inhibiteur des CYP hépatiques.
Effets indésirables
La plupart des effets indésirables imputables aux antibiotiques sont rapidement réversibles à l’arrêt du traitement. Il existe toutefois des situations de toxicité irréversible comme l’ototoxicité sous aminosides, ou les toxidermies bulleuses (syndromes de Stevens-Johnson et de Lyell) sous sulfamides, notamment.
Contrairement à une opinion assez largement répandue, les effets indésirables communs à toute une classe d’antibiotiques sont plutôt moins nombreux que ceux présentés spécifiquement par une molécule en particulier à l’intérieur d’une classe.
Par exemple, le risque de rupture du tendon sous fluoroquinolones est important avec la ciprofloxacine, alors qu’il est très faible avec la moxifloxacine.
De même, les réactions allergiques urticariennes avec les ß-lactamines imposent, par précaution, la prescription d’une autre classe antibiotique alors même que le risque croisé de réaction allergique immédiate entre pénicillines et céphalosporines ne semble pas dépasser 10%. Le tableau suivant présente les principaux effets indésirables répertoriés à doses thérapeutiques à l’intérieur des grandes classes d’antibiotiques.
Présentation des effets indésirables à doses thérapeutiques spécifiques aux principales classes d’antibiotiques
|
Classes |
Nature de l’effet indésirable |
Gravité |
Estimation de la fréquence |
En savoir plus sur l’effet indésirable |
|
Pénicillines |
- Choc anaphylactique |
- Modérée à sévère |
- rare (jusqu’à 0.04 %) |
- Risque > si voies IV, IM |
|
Céphalosporines |
- Manifestations d’hypersensibilité |
- Modérée à sévère |
Cf. pénicillines |
- Réactions croisées chez 5 à 10% des patients sous ß-lactamines |
|
Aminosides |
- Néphrotoxicité |
- Sévère |
- Fréquent (jusqu’à 30 %) |
- Réversibilité sans séquelles |
|
Macrolides |
- Troubles du tractus digestif |
- Faible à modérée |
- Fréquent (jusqu’à 30 %) |
- Réversibilité sans séquelles |
|
Quinolones et Fluoroquinolones |
- Tendinopathie et arthralgie |
- Modérée à sévère |
- Fréquent (jusqu’à 10 %) |
- Risque > si personne âgée |
|
Sulfamides |
- Eruptions cutanées |
- Modérée à sévère |
- Fréquent (jusqu’à 3 %) |
- Toxidermie irréversible |
|
Tétracyclines |
- Troubles du tractus digestif |
- Modérée |
- Fréquent (jusqu’à 15 %) |
- ulcère oesophagien et formes sèches |
Surveillance des effets
La surveillance d'un traitement antibiotique vise à s'assurer de son efficacité et de sa tolérance.
Au plan clinique, l'amélioration des symptômes initiaux et la baisse de la fièvre sont logiquement attendues dans les 72 heures suivant l'instauration du traitement, faute de quoi l'éventualité d'un échec clinique devient plausible.
Au plan biologique, on vérifie la normalisation des paramètres sensibles aux états infectieux comme la CRP, la procalcitonine, et ceux plus généraux comme la vitesse de sédimentation, la leucocytose, voire la sérologie. Le contrôle bactériologique peut s'avérer déterminant, en vérifiant la négativation des prélèvements, soit au cours du traitement (témoin d’efficacité), soit à distance du traitement (témoin de l’absence de rechute).
La surveillance microbiologique permet également d’objectiver une résistance bactérienne, ainsi que l'étude des interactions antibiotiques précisant les associations indifférentes, additives, synergiques ou antagonistes. Le pouvoir bactéricide du sérum (PBS) est un index mesurant la bactéricidie de dilutions progressives du sérum d'un patient sous traitement antibiotique. Index prédictif d'efficacité validé essentiellement au cours des endocardites à streptocoques et des infections chez le sujet neutropénique, le PBS reste d'interprétation délicate.
Le suivi thérapeutique par dosage sanguin des antibiotiques pourrait théoriquement remplacer la mesure du PBS. Actuellement cependant, seuls les aminosides et les glycopeptides font l'objet d'un suivi thérapeutique bien codifié avec dosage sanguin permettant d'apprécier tolérance et efficacité du traitement. Le suivi thérapeutique des bêta lactamines est également conseillé notamment pour les patients en réanimation.
Les index pharmacodynamiques décrits au paragraphe 7 (QI, AUIC, ∆t supra CMI) sont essentiellement des outils d’évaluation des antibiotiques avant commercialisation. Pourtant, leur intégration dans la surveillance clinique des effets pourrait rendre de précieux services pour optimiser les traitements des infections sévères, ou pour aider à la compréhension et l’interprétation d’une situation d’échec d’un traitement antibiotique.
>>> Pour en savoir plus :
1) http://www.infectiologie.com
Le site de l’infectiologie française (avec les conférences de consensus)
>>> Pour en savoir encore plus :
2) http://www.eMedguides.com puis lien “Infection diseases & Immunology”
