Antiarythmiques
Résumé de la fiche
Les médicaments antiarythmiques sont destinés à réduire la morbidité et si possible – mais ce n’est en règle générale pas le cas – la mortalité associées aux troubles du rythme cardiaque ventriculaires et supraventriculaires de type tachyarythmies.
Leur utilisation est délicate et relève essentiellement du spécialiste. Mais leur surveillance, en particulier pour le traitement de la Fibrillation Auriculaire (arythmies la plus fréquente) concerne tous les médecins de part le très grand nombre de patients concernés.
Les trois principales caractéristiques des antiarythmiques sont :
- Index thérapeutique étroit de la majorité des produits existants (avec effets indésirables potentiellement graves et, pour certains, mortels).
- Hétérogénéité des produits, de leurs propriétés pharmacocinétiques et des effets cellulaires et pharmacodynamiques/cliniques.
- Grande variabilité des effets thérapeutiques et indésirabes selon la nature de l'arythmie traitée et les pathologies cardiaques sous-jacentes.
L’utilisation thérapeutique des antiarythmiques est facilitée par la connaissance de leurs propriétés électrophysiologiques cellulaires. Celles-ci sont classées en 4 grandes classes (classification de Vaughan-Williams) :
- Classe I : les bloqueurs du canal sodique rapide (INa) eux-mêmes constitués en 3 sous-classes (a, b, c) selon l'intensité et la durée du blocage sodique (b < a < c).
- Classe II : les ß-bloquants.
- Classe III : les médicaments qui allongent la durée de la repolarisation ventriculaire (en bloquant les canaux potassiques).
- Classe IV : les inhibiteurs du courant calcique lent (ICaL).
Chaque classe est associée à des effets sur l'ECG et à des effets indésirables propres (tableau 1)
|
Classe I |
Classe II |
Classe III |
Classe IV |
|
|
Principal Effet Cellulaire |
diminution de la vitesse de conduction (↓ de Vmax) dans les cellules à réponse rapide |
β-bloquants |
allongement de la durée des Potentiels d'Action (PA) augmentation des périodes réfractaires (surtout pour les cellules à réponse rapide) |
- inhibition Calcique - augmentation des périodes réfractaires |
|
Principal Mécanisme de l'Effet |
Bloc de INa (canal sodique rapide) |
bloc des récepteurs β1 adrénergiques préférentiel (mais aussi des β2-adrénergiques) |
bloc de IKR, IKS et/ou IK1 (canaux potassiques) |
bloc de ICaL (canal calcique lent) |
|
Conséquences sur l'ECG |
allongement de QRS (Ic surtout) (± allongement PR) |
allongement de PR, diminution de la FC |
allongement de QTc (± diminution de la FC) |
allongement de PR, diminution de la FC |
|
Profil des Effets Indésirables Cardiaques |
- Arythmogénicité : conduction 1/1 à l'étage ventriculaire de certaines tachycardies supra-ventriculaires (flutters en particulier) - Inotropisme négatif - Bloc de conduction Hissien ou Intraventriculaire (QRS large) à l'origine de bloc auriculo-ventriculaire pouvant être de haut grade - Dysfonction sinusale - Augmentation des seuils de stimulation par les pacemakers et des seuils de défibrillation |
- Bradycardie - Blocs auriculo-ventriculaires ouvant être de haut grade - Inotropisme négatif |
- Arythmogénicité : Torsades de Pointes - Bradycardie - Blocs auriculo-ventriculaires ouvant être de haut grade |
- Bradycardie - Blocs auriculo-ventriculaires ouvant être de haut grade - Inotropisme négatif |
|
Exemples de Médicaments† |
Flécaïnide (c)* Propafénone (c)* Quinidine (a)* Disopyramide (a)* Cibenzoline (c)* Lidocaïne (b)* Méxilétine (b)* (Amiodarone (b)*) (Dronédarone (b)*) |
Propranolol Acébutolol Nadolol Aténolol Bisoprolol … (Sotalol) (Amiodarone) (Dronédarone) |
Amiodarone Sotalol Dronédarone Quinidine Disopyramide Non commercialisés en Europe : Ibutilide (I.V.) Dofétilide |
Vérapamil Diltiazem PAS LES DIHYDROPYRIDINES AUX DOSES STANDARS (doses conformes aux RCP) (Cibenzoline) (Amiodarone) (Dronédarone)
|
Tableau 1 : Classification des antiarythmiques et propriétés associées à chaque classe.
FC : fréquence cardiaque ; PR : intervalle PR ; QRS : intervalle QRS; QTc : QT corrigé pour la FC
† Dans une classe donnée, les médicaments entre parenthèses ont des effets de faible amplitude pour cette classe
* les effets de classe I sont subdivisés en Ia, Ib et Ic selon la puissance et la durée des effets de blocage du courant sodique (Ic > Ia > Ib).
De nombreux antiarythmiques possèdent des propriétés relevant de plusieurs de ces classes (tableau 2). On peut en déduire un profil d'effets électrocardiographiques et d’effets indésirables cardiovasculaires attendus pour chaque molécule.
|
Médicament (Dénomination Commune Internationale) |
Propriété(s) électrophysiologique(s) principale(s) |
|
Quinidine, Disopyramide |
Classe Ia et Classe III (avec risque de torsades de pointes) (+ effets anticholinergiques cardiaques) |
|
(Mexilétine), Lidocaïne : peu utilisés |
Classe Ib |
|
Propafénone, Flécaïnide, (Cibenzoline) |
Classe Ic (faibles effets de classe II avec la propafénone) |
|
Béta-bloquants comme antiarythmiques |
Classe II |
|
Sotalol, (Dofétilide, Ibutilide) |
Classe III (± β-bloquant pour sotalol) |
|
Amiodarone, Dronédarone |
Classe III avec effets de moindre amplitude de classe Ib, II et IV |
|
Inhibiteurs Calciques Bradycardisants (vérapamil et diltiazem) |
Classe IV |
Tableau 2 : Propriétés électrophysiologiques des principaux médicaments antiarythmiques.
Les faits marquants sur la toxicité des antiarythmiques selon les propriétés de classe peuvent être résumés de la manière suivante :
- Classe I :
- formellement contre-indiqués après un infarctus du myocarde ou chez l'insuffisant cardiaque.
- utilisation dangereuse chez les patients ayant une insuffisance coronaire ou présentant des troubles conductifs (bloc auriculo-ventriculaire, bloc de branche).
- peuvent augmenter la sévérité des arythmies traitées (arythmogènes) avec en particulier le risque de conduction 1/1 à l'étage ventriculaire de certaines tachycardies supra-ventriculaires (flutters en particulier).
- risque accru d'arrhythmogénicité en cas d'association avec les anti-arythmiques de classe III.
- Classe II :
- contre-indiqués chez les patients avec risque de bronchospasme (asthme - bronchopathies obstructives sévères).
- l'association à d'autres médicaments bradycardisants est délicate car susceptible d'entraîner des bradycardies symptomatiques (en particulier les inhibiteurs calciques bradycardisants).
- Classe III :
- risque, rare mais potentiellement mortel, de torsades de pointes du fait d'un allongement excessif du QTc : principalement avec les anti-arythmiques de classe III "purs" mais possible avec tous les anti-arythmiques présentant des propriétés anti-arythmiques de classe III.
- moindre risque de torsades avec amiodarone (du fait de ses propriétés de classe III non "pures" car possède aussi des propriétés Ib, II et IV).
- risque accru d'arrhythmogénicité en cas d'association avec les anti-arythmiques de classe I.
- Classe IV :
- contre-indiqués en cas d'insuffisance cardiaque avec dysfonction VG sévère.
- l'association à d'autres médicaments bradycardisants (bêta-bloquants) est délicate car susceptible d'entraîner des bradycardies symptomatiques.
Anti-arythmiques les plus precrits actuellement :
- Bien que de très nombreux anti-arythmiques existent sur le marché, la tendance thérapeutique ces dernières années est à la diminution de la prescription de ces médicaments à marge thérapeutique étroite dont la balance bénéfice-risque est devenue discutable pour certains.
- Les anti-arythmiques les plus prescrits actuellement et qu'il convient donc de bien connaitre sont : la flécaïnide parmi les anti-arythmiques de classe I (quasiment le seul régulièrement prescrit), les béta-bloquants (anti-arythmiques de classe II), l'amiodarone et le sotalol parmi les anti-arythmiques de classe III (quasiment les seuls régulièrement prescrits) et les inhibiteurs calciques bradycardisants ((anti-arythmiques de classe II).
Pour en savoir plus :
· Lien PubMed de revues générales (Liste d'articles publiés en Français)
· Un Cours spécialisé sur les antiarythmiques (en Anglais)
· Le Chapitre du Merck Manual sur les arythmies (en Anglais)
· Le site de l’American Heart Association sur les arythmies (en Anglais)
· Le site des Guidelines de l’European Society of Cardiology (en Anglais)
Item(s) ECN
230 : Fibrillation atriale232 : Insuffisance cardiaque de l'adulte
Rappel physiopathologique
Physiologie du rythme et de l’activité électrique cardiaque :
Les cellules du tissu cardiaque génératrices du rythme cardiaque normal ou pathologique se caractérisent par leur activité électrique portée par 4 propriétés fondamentales :
- Automatisme : Capacité de se dépolariser lentement et spontanément à partir d'un état polarisé au repos (au repos, l'intérieur des cellules est électriquement plus négatif que l'extérieur). L’automatisme assure l’émergence d’un rythme cardiaque.
- Excitabilité : Capacité de se dépolariser brutalement à partir d'un potentiel électrique (dit potentiel seuil) mettant fin à l'état de repos. L’excitabilité est nécessaire à la propagation des influx électriques.
- Conduction : Capacité de propager aux cellules voisines l'influx électrique résultant de la dépolarisation.
- Repolarisation : Capacité des cellules à se repolariser pour revenir à l'état (polarisé) de repos. Pour être à nouveau excitable, les cellules doivent s'être, au moins en partie, repolarisées.
Un cycle dépolarisation / repolarisation a lieu à chaque systole électrique et est associé de manière synchrone à un cycle contraction / relaxation musculaire qui permet au cœur d'assurer sa fonction hémodynamique à chaque battement.
Chaque cycle dépolarisation / repolarisation est responsable d'un potentiel d'action (PA) cellulaire. L'activité électrique du cœur peut être modifiée par les pathologies cardiaques, par les médicaments ou plus rarement par des anomalies constitutionnelles d’ordre génétique de fonctionnement de canaux ioniques qui modulent les courants formant le potentiel d’action.
Il existe, schématiquement, deux grands types de PA cellulaires, chacun étant associé à un type cellulaire particulier (figure 1) :
• Cellules à réponse lente: Également appelées cellules automatiques, elles sont principalement responsables de la genèse du rythme normal dans le nœud sinusal et du ralentissement des influx dans le nœud auriculo-ventriculaire. Elles ont un automatisme spontané.
• Cellules à réponse rapide : Également appelées cellules du tissu de conduction, elles sont caractérisées par l'existence d'un plateau (Phase 2 du PA) qui maintient la cellule dépolarisée pendant un certain temps (sous l'effet de l'entrée d'ion Ca++ par le courant calcique lent voltage-dépendant). Elles sont principalement responsables de la propagation des influx électriques dans le tissu de conduction et les cardiomyocytes.

Figure 1 : Deux grands types de Potentiels d’Action Cardiaque.
Les 5 phases de dépolarisation (phase 0 et 4) et repolarisation (phase 1, 2 et 3) existent dans chaque type cellulaire mais elles ne sont pas portées par les mêmes courants ioniques.
Finalement, un PA donné résulte d’échanges ioniques faisant entrer et sortir des charges électriques par différents canaux ioniques. Chaque type cellulaire (réponse lente et réponse rapide) a des propriétés différentes et est façonné par des transferts d’ions différents. Le tableau 3 résume ces propriétés variables.
|
Cellules à Réponse Lente |
Cellules à Réponse Rapide |
|
|
Localisation Principale |
|
|
|
Excitation / Conduction (Phase 0) |
||
|
Intensité Courant Ionique Principal |
+ ICa-L |
+++ INa rapide |
|
Repolarisation (Phases 1 et 3) |
||
|
Intensité |
Lente et immédiate
|
Rapide mais différée après le plateau (phase 2) IK |
|
Repolarisation (Phase 2) |
||
|
Plateau du PA |
Quasi absent |
Important |
|
Automatisme (Phase 4) |
||
|
Intensité Courant Ionique Principal |
+++ If |
+ ou 0 IK1 |
Tableau 1 : Caractéristiques schématiques des 2 grands types de cellules cardiaques impliquées dans le rythme cardiaque. + modéré ; +++ intense
La sommation de tous les PA génère un signal enregistrable sur l'électrocardiogramme (ECG) de surface. Ce signal est le reflet des différentes activités électriques du cœur (figure 2).
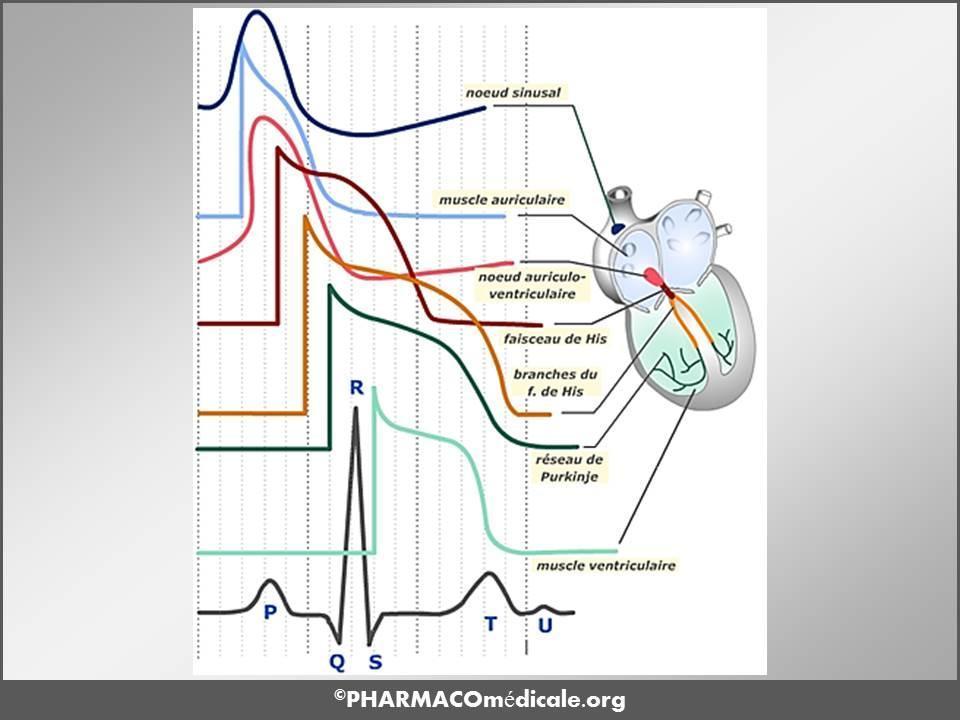
Figure 2 : Relations entre potentiels d’action cellulaires cardiaques et ECG de surface.
L’influx électrique se propage à partir du pacemaker naturel (nœud sinusal) vers les oreillettes, traverse le nœud auriculo-ventriculaire et se propage aux ventricules par les cellules à réponse rapide du faisceau de His et du réseau de Purkinje puis aux myocytes ventriculaires. Chaque onde de l’ECG correspond à une activité électrique particulière dans une zone anatomique particulière. La séquence temporelle peut être vue sur la figure 2. L’intervalle début de P - début du complexe QRS (intervalle PR) reflète principalement la vitesse de conduction dans le nœud auriculo-ventriculaire (AV) ; PR est donc allongé par les médicaments qui ralentissent la vitesse de conduction dans le nœud AV (effets de classe II et IV). La largeur du complexe QRS reflète la vitesse de conduction intraventriculaire ; il est donc allongé par les médicaments ayant des effets de classe Ic. L’intervalle QT reflète la durée du cycle complet dépolarisation - repolarisation ; il est principalement allongé par les médicaments ayant des effets de classe III.
On comprend facilement de ces relations que l’ECG est un moyen simple de suivre les effets des médicaments sur le cœur. A défaut de donner une information sur l’intérêt thérapeutique de ces médicaments, cela peut permettre de mesurer le degré d’exposition ou de surexposition d’un patient donné à un médicament donné.
Les troubles du rythme cardiaque:
Très schématiquement, les arythmies cardiaques sont dues à un trouble de la naissance des influx (troubles de l'automatisme normal ou activités déclenchées en cours de repolarisation), à un trouble de la conduction des influx (source de phénomènes dits de réentrées) ou à l'association de ces deux facteurs.

Figure 3 : Deux mécanismes princeps de genèse des troubles du rythme cardiaque.
À gauche, réentrée : A) Diagramme représentant la zone de bloc unidirectionnel et la dualité de conduction des influx électriques. La partie droite représente la durée de la période de bloc (longueur du rectangle noir) et la conduction dans le circuit. L’influx initial ne peut être conduit dans la zone du bloc unidirectionnel mais se propage dans l’autre branche du circuit. Lorsque l’influx remonte dans le circuit, il se trouve de l’autre côté de la zone du bloc initial. Mais cette zone a eu le temps de redevenir excitable (le bloc est donc unidirectionnel) et l’influx peut le franchir. Le courant électrique tourne alors en boucle dans ce circuit, dit de réentrée, et à chaque tour, envoie une impulsion au tissu cardiaque (flèche en direction du bas) ; B) La période réfractaire du bloc a été allongée par un médicament antiarythmique (classe I ou classe III) et le bloc est redevenu bidirectionnel ; C) La vitesse de conduction a été trop ralentie par un médicament antiarythmique aux effets de classe Ic prédominants et, malgré un allongement de la période réfractaire de la zone de bloc, l’influx peut tourner dans le circuit. C’est le principal mécanisme des effets proarythmiques des propriétés de classe Ic.
À droite, automatisme anormal : A et B) Des post-dépolarisations surviennent ;C) Elles aboutissent à une activité déclenchée, réexcitation qui permet la genèse d’un influx électrique ; D) Dans un contexte d’allongement majeur de la durée du potentiel d’action par un effet médicamenteux de classe III, des activités déclenchées successives sont générées. C’est le principal mécanisme des effets proarythmiques des propriétés de classe III.
Cliniquement, on distingue les troubles du rythme supra-ventriculaires (auriculaires et jonctionnels) et ventriculaires. Les troubles du rythme supra-ventriculaires sont plus invalidants que médicalement dangereux. Cependant, la fibrillation auriculaire est associée à un risque d’embolies artérielles. Les troubles du rythme ventriculaires répétitifs sont quant à eux associés à un risque potentiel de fibrillation ventriculaire et de mort subite.
La diversité des mécanismes engendrant les troubles du rythme cardiaque est un facteur de complexité majeure dans la manière de les traiter. Les différents troubles du rythme cardiaques connus cliniquement sont plus ou moins bien reliés aux mécanismes électrophysiologiques cellulaires des arythmies, eux-mêmes plus ou moins bien reliés aux anomalies des transferts ioniques déterminant la forme des potentiels d'actions.
Cependant, ces liens sont très imparfaits et ne permettent pas de choisir un médicament antiarythmique en fonction du seul mécanisme connu de l'arythmie et de son corollaire ionique, lorsqu'il existe.
Un degré additionnel de complexité dans la prise en charge des troubles du rythme cardiaque, quelle que soit leur nature, tient au fait que leur survenue est déterminée par plusieurs facteurs. La figure 3 illustre ce concept développé par Philippe Coumel.

Figure 4 : Facteurs associés à la genèse d’un trouble du rythme cardiaque.
Selon le modèle proposé par Philippe Coumel, l’émergence d’une arythmie résulte de la conjonction de trois facteurs :
1) un substrat arythmogène : trouble de l’automatisme et/ou de la conduction des influx, dû à une lésion anatomique du cœur (par exemple suite à un infarctus du myocarde ou à un remodelage auriculaire post-hypertensif),
2) un facteur déclenchant : ischémie, hypoxie, troubles ioniques, variation de fréquence cardiaque, extrasystole, médicaments,
3) l’activité du système nerveux autonome : balance sympatho-vagale qui module la façon dont le facteur déclenchant agit sur le substrat, voire module l’état du substrat ou du facteur déclenchant.
Au total, ce qui caractérise les troubles du rythme cardiaque c’est la multiplicité de leurs mécanismes de survenue. Cela rend la prédiction d’une réponse à un traitement médicamenteux donné, d’un trouble du rythme donné le plus souvent impossible.
Pour en savoir plus :
Médicaments existants
Le tableau ci-dessous liste pour chaque médicament antiarythmique les propriétés électrophysiologiques principales, les formes et doses utilisables ainsi que les posologies usuelles (se référer aux instructions officielles de prescription avant toute administration).
|
Médicament |
Propriétés |
Formes |
Posologie Quotidienne1 |
|
Lidocaïne |
Classe Ib |
Intraveineuse (ampoule et flacon) |
1 à 1,5 mg/kg en dose de charge puis 1,5 à 4 mg/min en perfusion continue |
|
Hydroquinidine |
Classe Ia Classe III Effets anti-cholinergiques modérés |
Orale Gélules LP 300mg |
600 à 1200 mg |
|
Disopyramide |
Classe Ia Classe III Effets anti-cholinergiques |
Orale Gélules 100 mg Orale Cp LP 125 mg et 250 mg (IV Ampoules 50 mg) |
400 à 600 mg 250 à 500 mg (voir RCP) |
|
Flécaïnide |
Classe Ic |
Orale Cp 100 mg Orale Gélule LP 50, 100, 150 et 200 mg Intraveineuse (hôpital) |
100 à 200 mg 100 à 300 mg
(voir RCP) |
|
Propafénone |
Classe Ic, (classe II) |
Orale Cp 300 mg |
600 à 900 mg |
|
Cibenzoline |
Classe Ic |
Orale Cp 130 mg |
2 à 3 Cp / jour |
|
Amiodarone |
Classe III, (classe Ib, II et IV) |
Orale Cp 200 mg
(IV Ampoules 150 mg) |
Dose de charge (cf. RCP). Puis 100 à 200 mg (voir RCP) |
|
Dronédarone |
Classe III, (classe Ib, II et IV) |
Orale Cp 400 mg |
400 mg x 2 |
|
Sotalol |
Classe III Classe II |
Orale Cp 80 mg Orale Cp 160 mg |
Dose initiale de 80 mg Puis 160 à 320 mg en 2 prises |
|
Vérapamil |
Classe IV |
Orale Cp 40 mg Orale Gélule 120 mg Intraveineuse |
120 à 240 mg 240 à 360 mg (voir RCP) |
|
Diltiazem |
Classe IV |
Orale Cp 60 mg Orale Cp LP 90, 120 mg Orale Gélule LP 200 et 300 mg Intraveineuse (ampoule et flacon) |
60 mg x 3 1 Cp x 2 1 Cp / jour
0,25 à 0,30 mg/kg IV en deux minutes |
Tableau 4 : Antiarythmiques utilisables en Europe.
1. Posologie moyenne recommandée en l’absence de diminution des capacités d’élimination. Se référer au RCP avant prescription.
Cp : comprimé ; LP : libération prolongée ; IV : intraveineuse ; RCP : Résumé des Caractéristiques du Produit ;
Deux antiarythmiques ayant des effets de classe III, le dofétilide et l’ibutilide, sont commercialisés dans certains pays mais pas en Enrope. La mexilétine a été retirée du marché en 2008.
Les digitaliques et l’adénosine ne sont pas à proprement parlé des médicaments antiarythmiques même si ils sont utilisés pour ralentir la vitesse de conduction du nœud auriculoventriculaire (par leurs propriétés vagotoniques). L’ivabradine, un bloqueur du courant If qui ralentit la fréquence de décharge du nœud sinusal, donc la fréquence cardiaque, n’a pas d’effet antiarythmique connu.
Mécanismes d’action des différentes molécules
La majorité des antiarythmiques ont des propriétés électrophysiologiques multiples et tous les troubles du rythme sont multifactoriels. Il est donc impossible de lier un mécanisme d’action spécifique d’un médicament vis-à-vis du traitement d’un trouble du rythme particulier. Néanmoins les généralités suivantes peuvent être formulées :
- Les mécanismes associés aux effets antiarythmiques de classe I et III sont également les mécanismes associés à leurs effets proarythmiques.
- La genèse des troubles du rythme étant liée à un trouble de la naissance des influx (automatisme anormal) et/ou à un trouble de la conduction des influx, ces deux facteurs constituent les cibles principales des médicaments antiarythmiques.
- Les effets de classe I (bloqueurs du canal sodique) et de classe III (allongement de la durée de la repolarisation) visent ces deux cibles.
- Les effets de classe I diminuent les automatismes anormaux et créent les conditions de ralentissement de la conduction permettant d’interrompre les circuits de réentrée (mais aussi de les provoquer, cf. Rappel Physiopathologique - figure 3)
- Les effets de classe III, par l’augmentation des périodes réfractaires, diminuent les automatismes et interfèrent avec les circuits de réentrée (sans pour autant modifier la vitesse de conduction des influx).
- Les mécanismes exacts des effets antiarythmiques des béta-bloquants (classe II) sont moins bien connus mais il est certain qu’ils passent largement par la réduction du tonus sympathique, lui-même source d’augmentation des automatismes normaux et anormaux et accélérateur de la conduction des influx.
La connaissance du mécanisme d’action des antiarythmiques n’est pas déterminante pour le choix de leurs indications thérapeutiques. Elle est en revanche très utile à la surveillance du traitement et à la prédiction de leurs effets indésirables.
Effets utiles en clinique
Le tableau suivant synthétise les principaux usages des médicaments antiarythmiques.
|
Médicaments |
Utilisations Thérapeutique Principales |
|
Quinidine, Disopyramide |
|
|
Lidocaïne |
|
|
Flécaïnide, Propafénone |
|
|
Béta-bloquants |
|
|
Sotalol |
|
|
Amiodarone |
|
|
Dronédarone |
|
|
Vérapamil, Diltiazem |
|
Le traitement médicamenteux des troubles du rythme relève en général du spécialiste.
Dans la fibrillation auriculaire, les antiarythmiques tels que le flécaïnide, la propafénone et l’amiodarone peuvent être utilisés pour tenter de traiter le trouble du rythme aigu récent et revenir en rythme sinusal. Mais le plus souvent, ces médicaments, et d’autres tels que le sotalol ou la dronédarone, sont utilisés pour prévenir les récidives après retour en rythme sinusal obtenu spontanément ou par choc électrique externe.
De nombreux médicaments antiarythmiques peuvent être utilisés pour traiter à la fois des arythmies supra-ventriculaires (auriculaires et jonctionnelles) et ventriculaires. Leur utilisation est le plus souvent limitée par le profil de leurs effets indésirables et de leurs contre-indications.
De nombreuses arythmies sont traitées, curativement ou préventivement, de manière non-médicamenteuse (méthodes ablatives ou palliatives) seule ou en complément des médicaments.
Pour en savoir plus :
- Lien PubMed de revues générales (Liste d'articles publiés en toutes langues)
- Le site des Guidelines de l’European Society of Cardiology (en Anglais)
Pharmacodynamie des effets utiles en clinique
Réponse aux médicaments antiarythmiques
Dans le traitement en aigu de la fibrillation auriculaire récente, les médicaments utilisables (flécaïnide, propafénone, amiodarone) ont un taux de succès - conversion en rythme sinusal dans les 24 ou 48 hr - de l’ordre de 40 à 80 % selon les études et selon les médicaments. Ces taux de succès sont un peu moins du double de ceux observés sous placebo. Une variabilité considérable existe entre les différentes études, s'expliquant probablement en grande partie par le profil hétérogène des patient inclus (avec ou sans cardiopathie structurelle sous-jacente, FEVG...). En l’absence de contre-indications (et surtout en l'absence de cardiopathie sous-jacente, en particulier l'absence d'une dysfonction systolique ventriculaire gauche), il faut privilégier un traitement « minute » de l’arythmie par la prise orale d’une dose de 200 ou 300 mg de flécaïnide qui se révèle souvent efficace au début de la maladie et entraine un retour en rythme sinusal plus rapide qu'avec les deux autres molécules. Aucune méthode ne permet de prédire qu’un médicament donné sera plus efficace qu’un autre.
Dans la prévention des récidives de fibrillation auriculaire, si le choix se porte sur cette cible thérapeutique et non sur un simple contrôle de la fréquence cardiaque en fibrillation auriculaire, les taux de succès sont relativement modestes. Sous placebo, le taux de récidive à un an est de l’ordre de 60 à 80 % et, globalement, les médicaments antiarythmiques utilisés dans cette indication (flécaïnide, propafénone, amiodarone, sotalol, dronédarone) doublent la probabilité de rester en rythme sinusal. L’amiodarone est plus efficace mais aussi plus toxique que les autres médicaments utilisés dans cette indication (effets indésirables extra-cardiaques en particulier). Dans cette indication, la place des anti-arythmiques se restreint de plus en plus au profit de l'ablation dont les taux de succès sont au moins équivalents et l'ablation afranchit le patient du risque d 'effets indésirables médicamenteux.
Dans les troubles du rythme ventriculaire graves (tachycardies ventriculaires) la prescription des médicaments antiarythmiques a été modifiée du fait de l'arrivée des dispositifs médicaux de type défibrillateur automatique implantable. Les médicaments antiarythmiques restent cependant souvent indispensables afin de limiter la survenue d'arythmies conduisant à mettre en action les défibrillateurs (et donc à user plus rapidement les batteries des appareils et donc à la nécessité d'une réintervention afin de changer le dispositif; par ailleurs le déclenchement des défibrillateurs est très mal vécu par les patients et donc il reste très utile d'essayer de prévenir les récidives de troubles du rythme ventriculaires à l'aide des anti-arythmiques).
Les arythmies non soutenues bénignes (isolées ou spontanément et rapidement résolutives, sans cardiopathie sous-jacente) lorsqu'elles sont très invalidantes et mal ressenties, qu’elles soient supraventriculaires ou ventriculaires, relèvent d’un traitement symptomatique. Celui-ci repose souvent sur l’utilisation des béta-bloquants (sans Activité Sympathomimétique Intrinsèque) afin de réduire la perception des arythmies.
Surveillance des traitements
Le degré d’exposition d’un patient donné à un médicament donné peut être évalué par la mesure de paramètres simples cliniques et électrocardiographiques. Ces éléments peuvent être résumés de la manière suivante :
- Effets de classe I :
Les antiarythmiques ayant des effets de classe Ic (flécaïnide, propafénone) allongent la durée de l’intervalle QRS de l’ECG dans des gammes physiologiques de fréquence cardiaque.
Cet allongement de QRS est attendu, lié à la dose administrée et à la concentration en principes actifs. Il traduit le ralentissement de la conduction électrique intra-ventriculaire et permet d’estimer l’amplitude de ce ralentissement. La durée de PR est également modérément allongée et témoigne de l’imprégnation attendue.
Un allongement modéré de la durée de QRS au repos en présence d’un effet de classe Ic est donc normal et souhaité (car reflète une exposition plasmatique à ces médicaments à priori normale). Mais cet allongement ne doit pas dépasser 20 à 25 % de la valeur de base avant traitement et surtout doit faire arrêter le traitement s'il est associé à l'apparition d'un bloc de branche, d'un bloc auriculoventriculaire ou sino-auriculaire (dans ce cas, cela évoque un surdosage plasmatique).
L’allongement de QRS associé aux effets de classe Ic est amplifié par l’augmentation de la fréquence cardiaque. Un allongement de QRS de 20 % sous flécaïnide ou propafénone au repos peut aboutir à un bloc de conduction médicalement dangereux si le patient fait un effort qui accélère sa fréquence cardiaque (d'ou la réalisation régulière par les cardiologues d''épreuves d'effort au cours du suivi des patients traités par anti-arythmiques de classe Ic).
L’allongement de QT avec les médicaments ayant des effets de classe Ia n’est pas dû à ces propriétés mais au fait que ces médicaments ont également des effets de classe III.
- Effets de classe III :
Les antiarythmiques ayant des effets de classe III (sotalol, amiodarone, dronédarone, quinidine, disopyramide) allongent la durée de l’intervalle QT/QTc de l’ECG et l’amplitude de cet effet sur l’ECG permet de suivre l’exposition à ces médicaments.
Sauf avec la quinidine, il existe une relation entre la dose administrée et le degré d’allongement de QT/QTc.
Un allongement excessif (> 500 ms) de QT ou QTc est un facteur de risque majeur de survenue de Torsades de pointes, un effet indésirable rare mais potentiellement mortel.
La mesure de la durée de QT/QTc est un aspect important de la surveillance d’un traitement ayant des effets de classe III.
La mesure de QT/QTc est cependant difficile et souvent mal faite par les médecins non spécialistes comme par les appareils ECG.
- Effets de classe II et IV :
Les antiarythmiques ayant des effets de classe II (tous les β-bloquants) et IV (vérapamil, diltiazem) peuvent aisément être surveillés en mesurant la fréquence cardiaque et la durée de l’intervalle PR.
Une baisse de fréquence cardiaque est attendue et ne témoigne pas d’une toxicité lorsqu'elle n'est pas excessive et qu'elle reste bien tolérée cliniquement. Sa constatation fait même partie de la vérification d’une imprégnation suffisante et d'une bonne observance médicamenteuse.
Caractéristiques pharmacocinétiques utiles en clinique
|
Nom |
Voie(s) (%) |
Biodispo-nibilité (%) |
Demi-vie (h) |
Commentaires |
|
Quinidine |
Foie : 70 - 90 |
70 - 80 |
4 - 17 |
Forte potentialité à induire des torsades de pointes mais non prévisible selon la dose ou la concentration. Métabolite contribuant (faiblement) à l'activité : 3-hydroxyquinidine. |
|
Disopyramide |
Foie : 40 - 60 |
80 - 90 |
4 -10 |
Métabolite modestement actif : N-désisopropyldisopyramide. |
|
Lidocaïne |
Foie > 95 |
N/A |
1,5 - 4 |
Métabolites contribuant à la toxicité neurologique centrale: Glicinexylidide (GX) et Monoéthyl-GX |
|
Méxilétine |
Foie > 95 |
75 - 85 |
12 - 24 |
Retiré du marché Européen |
|
Cibenzoline |
Foie : 40 -50 |
85 - 95 |
7 - 10 |
Très peu de données avec ce médicament |
|
Flécaïnide |
Foie : 70 - 80 |
80 - 90 |
10 - 20 |
Sujet au polymorphisme CYP2D6 mais incidence clinique faible, sauf en cas d’insuffisance rénale. |
|
Propafénone |
Foie : 80 - 90 |
10 - 50 |
6 - 12 |
Métabolite actif dépendant du polymorphisme CYP2D6 : 5-hydroxypropafénone - incidence clinique certaine. |
|
Sotalol |
Rein > 95 |
80 - 90 |
8 - 10 |
Formé de 2 énantiomères dont seul le l-(-) a des effets béta-bloquants |
|
Amiodarone |
Foie > 95 |
30 - 80 |
15 - 30 h 20 - 90 jours (doses répétées) |
Métabolite actif : N-deséthylamiodarone (équipotent et équitoxique à l'amiodarone) Inhibiteur enzymatique (CYP3A et CY2D6) |
|
Dronédarone |
Foie > 95 |
15 avec un repas |
25 - 30 |
La biodisponibilité est augmentée (x 2 à 4) par l’alimentation Inhibiteur enzymatique (CYP3A et CY2D6) |
|
Diltiazem |
Foie > 95 |
30 - 50 |
4 - 6 |
Métabolite modestement actif : désacétyl-diltiazem Inhibiteur enzymatique (CYP3A) |
|
Vérapamil |
Foie > 95 |
20 - 40 |
3 - 7 |
Énantiomères au profil d'action différent. Métabolite modestement actif : norvérapamil Puissant inhibiteur enzymatique (CYP3A) Puissant inhibiteur de la P-gp |
1. Contribution du foie et du rein à l'élimination du produit parent. L'élimination hépatique ne constitue pas nécessairement une voie d'inactivation pour les médicaments formant un ou plusieurs métabolites actifs.
Le suivi thérapeutique pharmacologique des médicaments antiarythmiques (dosage plasmatique des médicaments) n’est pas justifié en routine.
Source de la variabilité de la réponse
La réponse aux médicaments antiarythmiques est susceptible de varier, d’une part, du fait de particularités liées à la pathologie sous-jacente ou à l’arythmie traitée et, d’autre part, par des sources de variabilité pharmacocinétiques ou dynamiques (âge, fonction rénale, médicaments concomittants...).
Les effets des antiarythmiques ayant des propriétés de classe I sont potentialisés par l’ischémie myocardique. Le blocage du canal sodique est amplifié dans les tissus ischémiques au point d’exercer des effets toxiques (dépression majeure de la conduction des influx et effet inotrope négatif). Les antiarythmiques de classe I sont donc formellement contre-indiqués en cas d’ischémie myocardique.
- Puissant inhibiteur du CYP2D6 susceptible de transformer un « métaboliseur rapide » en pseudo « métaboliseur lent ».
- Inhibe l’élimination rénale de la digoxine et augmente ses concentrations plasmatiques et ses effets.
- Métabolisée par le CYP3A4 et donc susceptible de voir ses concentrations augmentées ou diminuées, respectivement par un inhibiteur ou un inducteur de cet enzyme.
- Métabolisée par le CYP3A4 et donc susceptible de voir ses concentrations augmentées ou diminuées, respectivement par un inhibiteur ou un inducteur de cet enzyme.
- L’amiodarone et la fluvoxamine augmentent les concentrations circulantes de lidocaïne
- L’inflammation (y-compris celle de la phase aigue de l’infarctus du myocarde) augmente la protéine porteuse de la lidocaïne et est susceptible de réduire les effets de la lidocaïne.
- La flécaïnide est métalisée par le CYP2D6; la co-prescription de flécaïnide avec un inhibiteur du CYP2D6 (antidépresseur par exemple), peut conduire à surdosage plasmatique en flécaïnide et donc en une toxicité de la flécaïnide.
- L’amiodarone augmente les concentrations de flécaïnide (l’association est exceptionnelle et réservée à de rares indications posées par des spécialistes et le plus souvent chez des patient appareillés d'un défibrillateur automatique implantable).
- Augmente les effets des antivitamine K par un mécanisme peu clair.
- Inhibiteur enzymatique du CYP2D6 et du CYP3A4 susceptible de modifier l’élimination de nombreux produits métabolisés par ces enzymes (se référer aux RCP pour les détails)
- Augmente les effets des anticoagulants oraux.
- Métabolisée par le CYP3A4 et donc susceptible de voir ses concentrations augmentées ou diminuées, respectivement par un inhibiteur ou un inducteur de cet enzyme.
- Inhibiteur enzymatique du CYP2D6 et du CYP3A4 susceptible de modifier l’élimination de nombreux produits métabolisés par ces enzymes (se référer aux RCP pour les détails)
- Substrats et/ou inhibiteur du CYP3A4.
- Ils peuvent augmenter les concentrations des médicaments dont le métabolisme dépend de cet enzyme.
- Le vérapamil augmente la concentration du lithium chez les patients traités par ce régulateur de l’humeur.
- Le vérapamil est un inhibiteur puissant de la P-gp susceptible de modifier le métabolisme de nombreuses molécules substrats de la P-gp.
Situations à risque ou déconseillées
La classification de Vaughan Williams des propriétés électrophysiologiques des antiarythmiques est utile pour prédire les situations à risque de la prescription des médicaments antiarythmiques. Ces situations sont déterminées par le profil des effets indésirables de ces médicaments (voir ce chapitre). Le tableau ci-dessous synthétise les principales situations à risque et contre-indications liées aux propriétés des médicaments antiarythmiques.
|
|
Situations à Risque |
Contre-indications |
Médicaments Potentiellement Concernés |
|
Classe I |
|
|
|
|
Classe II |
|
|
|
|
Classe III |
|
|
|
|
Classe IV |
|
|
|
Précautions d’emploi
Les précautions d’emploi pour les antiarythmiques découlent des situations à risque décrites dans la section correspondante. Toutefois des règles simples peuvent être observées pour réduire la toxicité de ces médicaments :
- Respecter les non-indications et contre-indications.
- Débuter par des doses faibles en augmentant progressivement les doses si les marqueurs de réponse ne sont pas satisfaisants en cherchant systématiquement la dose minimale efficace.
- Surveiller régulièrement les marqueurs cliniques et électrocardiographiques de réponse (fréquence cardiaque, intervalles PR, QRS, QTc, …).
- Sauf cas particulier relevant des spécialistes, ne pas administrer ces médicaments chez des patients en situation clinique instable.
- Sauf cas particulier relevant des spécialistes, ne pas associer plusieurs médicaments antiarythmiques chez un même malade (sauf l'association flécaïnide + bétabloquant ou l'association amiodarone + bétaboquant qui sont faites régulièrement).
L’association de médicaments, cardiovasculaires ou non, ayant des effets de classe I à IV de la classification des propriétés antiarythmiques est une source d’amplification des effets correspondants qui peut aboutir à ces effets indésirables.
Par exemple :
- L’administration d’un inhibiteur calcique bradycardisant et d’un beta-bloquant peut entraîiner une bradycardie excessive ou un bloc auriculo-ventriculaire de haut degré avec des symptômes allant de la fatigue à la syncope.
- L’administration d’un bloqueur potassique (classe III) avec un autre traitement ayant des effets de classe III (un antibiotique, un neuroleptique parmi ceux qui ont de tels effets non souhaités) favorise le risque de survenue d’une torsade de pointes.
- Garder présent à l’esprit que la réponse à un traitement antiarythmique dépend de l’arythmie traitée et de la pathologie sous-jacente.
Effets indésirables
La classification de Vaughan Williams des propriétés électrophysiologiques des antiarythmiques est utile pour prédire les effets indésirables liés à la prescription des médicaments antiarythmiques.
Les bloqueurs du canal sodique rapide ont obligatoirement des effets inotropes négatifs. L'intensité de cet effet inotrope négatif est proportionnel au degré de blocage des canaux sodiques (Ib < Ia < Ic). Cependant, les effets inotropes négatifs des différentes molécules exerçant des effets de classe I dépendent non seulement de leur appartenance à une sous-classe mais également de leurs propriétés annexes. Les effets inotropes négatifs des médicaments exerçant des effets de classe I constituent cependant un problème majeur pour leur utilisation chez les patients ayant une fonction ventriculaire gauche altérée, chez lesquels ils sont contre-indiqués car susceptibles d'entraîner une poussée d'insuffisance cardiaque. Cette potentialité est particulièrement marquée chez les patients ayant une insuffisance coronaire puisque le blocage des canaux sodiques par les médicaments ayant un effet de classe I est augmenté au cours de la dépolarisation cellulaire telle qu'elle existe lors d'un épisode d'ischémie coronaire. C’est la raison pour laquelle les bloqueurs du canal sodique sont formellement contre-indiqués en cas d’insuffisance cardiaque ou d’ischémie coronaire.
Le ralentissement excessif de la vitesse de conduction peut aboutir à des blocs de conduction, Hissiens ou intraventriculaires, sources de blocs infra-nodaux ou de blocs de branche. Mais surtout, le ralentissement de la vitesse de conduction, principalement par les effets de type Ic et plus accessoirement par ceux de type Ia, est susceptible de faciliter des arythmies cardiaques, parfois létales, et ce de deux manières :
- À l'étage ventriculaire, un effet de classe I peut favoriser la pérennisation d'un circuit de réentrée en ralentissant l'influx de telle sorte qu'il atteint une zone de bloc après qu'elle soit sortie de sa période réfractaire.
- À l'étage supra-ventriculaire, un effet de classe Ic est susceptible de ralentir la fréquence d'un flutter auriculaire conduisant à une conduction "dégradée" aux ventricules (flutter "quinidinique" ou "flécaïnique") : par exemple, sous flécaïnide, un flutter auriculaire peut passer d'une conduction 3/1 à une conduction 2/1 aux ventricules, à l'origine d'une cadence ventriculaire plus rapide et par conséquent moins bien tolérée par le patient.
Ces mécanismes expliquent les effets proarythmiques des médicaments exerçant des effets de classe I, surtout de type Ic, qui constituent un problème majeur de leur utilisation clinique. Lors des intoxications par le flécaïnide ou la propafénone avec QRS très large et blocs de conduction, l’administration en soins intensifs de bicarbonate ou de lactate de sodium molaire a pu entraîner une réversion des troubles conductifs.
Enfin, les effets de classe I, surtout Ia et Ic, élèvent les seuils de défibrillation du coeur et les seuils de stimulation endocavitaires. Cette propriété est une source potentielle d'effets indésirables chez les patients nécessitant une stimulation cardiaque ou chez lesquels un défibrillateur implantable a été mis en place.
Le blocage des récepteurs β-adrénergiques peut entraîner un ralentissement excessif de la fréquence sinusale et un bloc de la conduction auriculo-ventriculaire. Ces manifestations, qui ont pour conséquence une bradycardie, sont favorisées par les doses élevées ou par le fait que les sujets exposés au traitement ont une altération de leur fonction sinusale ou de leur conduction auriculo-ventriculaire de base, par exemple du fait de leur âge élevé ou de la co-administration de médicaments altérant les fonctions d'automatisme du coeur.
La fonction β-adrénergique déterminant en partie la force de contraction du muscle cardiaque, les médicaments exerçant des effets de classe II peuvent diminuer cette force de contraction et induire une insuffisance cardiaque. Il faut cependant garder présent à l'esprit que, lorsqu’ils sont administrées à dose faibles et progressivement croissantes sur la base d’une bonne tolérance, les β-bloquants réduisent la morbi-mortalité au cours de l'insuffisance cardiaque et ce, vraisemblablement en partie par un effet antiarythmique.
Le principal effet indésirable cardiaque associé aux effets de classe III, pour ainsi dire le seul, est une forme particulière d'arythmogénicité appelée torsade de pointes. Cet effet proarythmique n'a rien en commun avec l'arythmogènicité liée aux effets de classe I décrite plus haut. Les torsades de pointes sont des troubles du rythme ventriculaire extrêmement rapides qui peuvent se terminer spontanément ou dégénérer en fibrillation ventriculaire mortelle. Leur traitement médical est simple (magnésium parentéral, correction d'une éventuelle hypokaliémie et accélération de la fréquence cardiaque) mais leur survenue inopinée à distance de tout contrôle médical les rend potentiellement très graves.
Figure 5 : Torsade de Pointes.
La torsade est ici spontanément résolutive. Noter l’allongement de l’intervalle QT
Il n'est pas prouvé que la potentialité d'induire des torsades de pointes soit un effet indésirable inéluctable de tous les médicaments qui allongent la durée de la repolarisation. Cependant, qu'ils soient destinés ou non à être utilisés dans le traitement des troubles du rythme cardiaque, tous les médicaments qui allongent la durée de la repolarisation ventriculaire et pour lesquels on dispose d'un recul suffisant pour que de nombreux sujets y aient été exposés, ont pu être responsables de torsades de pointes. Pour un médicament donné, cet effet indésirable n'est pas directement lié au niveau de la prolongation de la durée de l'intervalle QT ou QTc et il est nécessaire que se surajoutent à l'effet de classe III un ou plusieurs facteurs favorisants tels qu'un ralentissement excessif de la fréquence cardiaque, une hypokaliémie, une ischémie ou des facteurs génétiques prédisposants.
En revanche, les effets de classe III sont remarquablement neutres sur d'autres paramètres modifiés par les médicaments appartenant aux autres classes. Les effets de classe III ne sont notamment associés à aucun bloc de conduction auriculo-ventriculaire ou intra-ventriculaire et à aucune dépression de l'inotropisme cardiaque. L'allongement de la durée de la repolarisation est même associé à un effet inotrope positif modéré.
Les effets indésirables des inhibiteurs calciques (classe IV) non dihydropyridiniques (= inhibiteurs calciques bradycardisants) sont : blocs auriculo-ventriculaires, bradycardie sinusale ou bloc sino-auriculaire et dépression de l'inotropisme cardiaque.
En dehors de ces effets liés aux propriétés électrophysiologiques intrinsèques des antiarythmiques, certains effets indésirables sont propres à chaque molécule :
Pour les interactions médicamenteuses, se référer à la section « Sources de variabilité de la réponse ».
|
Médicament |
Particularité de Certains Effets Indésirables |
|
Quinidine |
|
|
Disopyramide |
|
|
Lidocaïne |
|
|
Cibenzoline |
|
|
Flécaïnide |
|
|
Propafénone |
|
|
Amiodarone |
|
|
Dronédarone |
|
|
Diltiazem |
|
|
Vérapamil |
|
Surveillance des effets
Compte-tenu de la fréquence et potentielle gravité de leurs effets indésirables, la prescription de TOUS les médicaments antiarythmiques nécessite une étroite surveillance, surtout en début de traitement ainsi qu'une réévaluation régulière.
Pour les médicaments ayant des effets prédominants de classe I
- Au plan clinique
- Vérification de l’absence de signes d’insuffisance cardiaque
- Vérification de l’absence de palpitations, de syncope ou pré-syncopes
- Au plan ECG
- Vérification de l’absence d’élargissement excessif (> 25 % du niveau de base) des complexes QRS
- Vérification de l’absence d’allongement excessif de PR ou de bloc auriculo-ventriculaire de grade > I
- Vérification de l’absence de dysfonction sinusale
- Vérification éventuelle des seuils de stimulation des pacemakers
Pour les médicaments ayant des effets prédominants de classe II
- Au plan clinique
- Vérification de l’absence de bronchospasme
- Vérification de l’absence de bradycardie excessive et symptomatique
- Vérification de l'absence d'hypotension orthostatique
- Au plan ECG
- Vérification de l’absence de bradycardie sinusale excessive
- Vérification de l’absence d’allongement excessif de l'intervalle PR ou de bloc auriculo-ventriculaire de grade > I
Pour les médicaments ayant des effets prédominants de classe III
- Au plan clinique
- Vérification de l’absence de palpitations, de syncope ou pré-syncopes
- Au plan ECG
- Vérification de l’absence d’allongement excessif de l’intervalle QT ou QTc (> 500 ms)
Pour les médicaments ayant des effets prédominants de classe IV
- Au plan clinique
- Vérification de l’absence de signes d’insuffisance cardiaque
- Vérification de l’absence de bradycardie excessive et symptomatique
- Vérification de l'absence d'hypotension orthostatique
- Au plan ECG
- Vérification de l’absence de bradycardie sinusale excessive
- Vérification de l’absence d’allongement excessif de PR ou de bloc auriculo-ventriculaire de grade > I
Pour chaque médicament spécifique
Vérification de l’absence d’effets indésirables spécifiques à chaque molécule (cf. effets indésirables)
Par ailleurs, la surveillance de la réponse thérapeutique dépend de l’arythmie traitée et repose sur les données cliniques, ECG et Holter.
