Aminosides
Résumé de la fiche
Les aminosides sont des antibiotiques bactéricides utilisables en première intention par voie parentérale dans les infections sévères à germes Gram négatif aérobies. Leur incontestable intérêt clinique est tempéré par une toxicité cochléo-vestibulaire et une toxicité rénale qui peuvent être réduites par la surveilllance des concentrations plasmatiques.
Item(s) ECN
173 : Prescription et surveillance des anti-infectieux chez l'adulte et l'enfant326 : Prescription et surveillance des classes de médicaments les plus courantes chez l'adulte et chez l'enfant
Médicaments existants
Les aminosides comprennent les molécules suivantes :
gentamicine, amikacine, netilmicine, tobramycine, isépamicine, néomycine, streptomycine et spectinomycine.
Les trois derniers sont particuliers : la néomycine est trop toxique pour être utilisable autrement qu’en local, la streptomycine est le seul aminoside antituberculeux et la spectinomycine n’est qu’apparentée aux aminosides, et ne s’utilise que comme anti-gonnococcique.
Figure 1 : formules des aminosides

Mécanismes d’action des différentes molécules
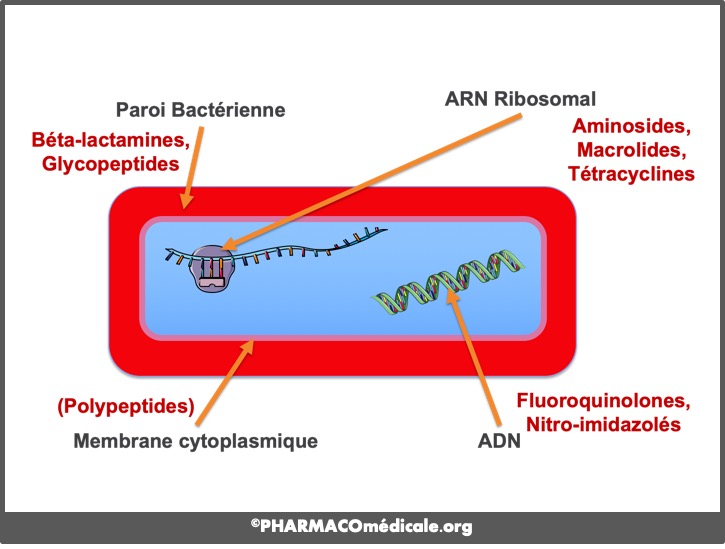
Ces molécules traversent la paroi et pénètrent la membrane par un mécanisme de transport qui consomme de l’oxygène. Dans la bactérie, les aminosides se fixent sur les ribosomes pour perturber la synthèse protéique.
Figure 2 : Mécanisme d'action des antibiotiques
Les résistances acquises sont transmises par des plasmides qui codent de multiples enzymes dénaturant les aminosides.
Effets utiles en clinique
Spectre d’activité antibactérienne :
Ce sont des antibiotiques bactéricides concentration-dépendant à effet post-antibiotique marqué. Les aminosides sont réservés aux infections sévères, pour lesquelles l’efficacité sera contrôlée par antibiogramme. Le spectre commun aux aminosides et les principales indications sont indiqués dans la figure voisine. Lorsqu’ils sont associés aux beta-lactamines, les aminosides étendent leur spectre vers les cocci Gram (+), Staphylo MétiS et Streptocoque. A noter, les indications spécifiques de la streptomycine dans la tuberculose, de la spectinomycine dans les gonococcies et l’usage exclusivement local de la néomycine en raison de sa toxicité.
Figure 3 : Spectre d’activité antibactérienne

Caractéristiques pharmacocinétiques utiles en clinique
Produits très polaires, non résorbés, non métabolisés, ils sont éliminés par filtration glomérulaire. Leur demi-vie est courte (2h) mais très dépendante de la fonction rénale. En cas d'insuffisance rénale, une adaptation de posologie sera donc nécessaire en fonction de la clairance de la créatinine. Leur diffusion est extracellulaire. Les concentrations tissulaires sont en général plus basses que les concentrations plasmatiques, sauf dans les liquides pleuraux, synoviaux ou dans le placenta. La diffusion est pratiquement nulle dans le liquide céphalo-rachidien (même inflammatoire) ou dans les tissus adipeux. La posologie doit donc être adaptée au poids maigre. Ils s’accumulent dans le cortex rénal et l’oreille interne d’où leur toxicité.
Tableau 1 : Cinétique des aminosides
|
Adminstration |
Excrétion urinaire (%) |
Liaison protéique (%) |
Vol. Distribution (l/kg) |
Demi-vie (h) |
Cp max (mg/l) |
Cp résiduelle (mg/l) |
|
|
amikacine |
IM, IVlente |
>90 |
<10 |
0,3 |
2-3 |
20-30 |
<5 |
|
dibékacine |
IM, IVlente |
||||||
|
gentamicine |
IM, IVlente |
>90 |
<10 |
0,3 |
2-3 |
5-10 |
<2 |
|
isépamicine |
IM, IVlente |
||||||
|
néomycine |
topique |
(non pertinent : diffusion suposée nulle) |
|||||
|
netilmicine |
IM, IVlente |
80-90 |
<10 |
0,2 |
2-3 |
5-12 |
<2 |
|
spectinomycine |
IM, IVlente |
||||||
|
streptomycine |
IM, IVlente |
50-60 |
48 |
0,25 |
2-3 |
||
|
tobramycine |
IM, IVlente |
>90 |
<10 |
0,33 |
2-3 |
5-10 |
<2 |
Source de la variabilité de la réponse
Les indications des aminosides doivent être documentées. L’élimination est ralentie chez le nouveau-né et le prématuré. Les traitements prolongés ou les traitements itératifs par les aminosides augmentent leur toxicité.
Situations à risque ou déconseillées
- Allergie aux aminosides
- Myasthénie
Précautions d’emploi
La surveillance doit être renforcée chez les sujets présentant des anomalies vestibulaires ou auditives. Chez l’insuffisant rénal, la posologie doit être adaptée en fonction de la lairrance rénale et ajustée à l’aide des dosages sériques. En cas d’intervention chirurgicale, l’anesthésiste doit être informé de ce type de traitement. L’emploi des aminosides est déconseillé pendant la grossesse en raison du risque d’atteinte cochléo-vestibulaire du fœtus.
Effets indésirables
Les aminosides sont néphrotoxiques et ototoxiques. L’élimination des aminosides de l’oreille interne et du cortex rénal est lente et fonction du gradient de concentration avec le plasma. Leur toxicité est favorisée par les traitements de plus de 5 jours, le grand âge et évidemment l’insuffisance rénale.
L’accumulation dans le tube contourné proximal conduit à une réduction de la filtration glomérulaire responsable d’une augmentation de la créatininémie. Cette toxicité est souvent réversible parce que les cellules proximales sont capables de régénérer. Elle est potentialisée lorsqu’on utilise des associations avec d’autres néphrotoxiques. L’accumulation dans l’oreille interne détruit progressivement les cellules ciliées de la cochlée ce qui peut conduire à une surdité définitive ou provoquer des acouphénes. Elle détruit aussi les cellules ciliées des canaux semi-circulaires d’où ataxie, vertiges et troubles de l’équilibre.
Interactions médicamenteuses avec les médicaments néphro ou ototoxiques. Les aminosides potentialisent les médicaments de la plaque motrice (curarisants, myorelaxants, anesthésiques généraux).
Tableau 2 : Toxicité des aminosides
|
Nature de l'effet |
Gravité |
Fréquence |
Pour en savoir plus |
|
Nephrotoxicité |
Grave |
3-11% |
A |
|
Ateinte de la VIII paire cranienne |
|
|
|
|
1) Vestibulaire |
Modérée ou grave |
10%* |
B |
|
2) Cochléaire |
Modérée ou grave |
26% * |
B |
|
Atteinte neuromusculaire |
potentiellement létale |
obs |
C |
Tableau 3 : Détail des liens de la colonne "pour en savoir plus"
|
A - Nephrotoxicité |
||
|
Nature de l'effet |
Insuffisance rénale à diurèse conservée |
|
|
Necrose tubulaire |
||
|
Facteurs de risques : |
||
|
1) Cliniques |
Insuffisance rénale, age |
|
|
Septicémie, deshydratation, hyperthermie |
||
|
2) Thérapeutique |
Dose, dose cumulée, durée du traitement |
|
|
Traitement antérieur par aminosides * |
||
|
Méthode diagnostique |
Clairance de la créatinine |
|
|
Prévention |
Eviter de cumuler les facteurs de risque |
|
|
Eviter les autres traitements nephrotoxiques |
||
|
Dosage plasmatique des aminosides |
||
|
Traitement |
Adaptation posologique |
|
|
Arrêt des aminosides |
||
|
B - Ateinte de la VIII paire cranienne |
Remarque : ces lésions sont irréversibles |
|
|
Nature de l'effet |
||
|
1) Vestibulaire |
vertiges, ataxie, nystagmus |
Peuvent passer inaperçu chez le malade alité |
|
Peuvent être très invalidantes |
||
|
2) Cochléaire |
acouphènes, baisse de l'acuité auditive |
Peuvent passer inaperçu car commence par une baisse de perception des fréquences aiguës en dehors du spectre sonore normal |
|
Facteurs de risques : |
||
|
Les mêmes que pour la néphrotoxicité + hypoacousie antérieure |
Remarque : on peut trouver des résidus d'aminosides dans la cochlée des mois après le traitement |
|
|
Facteur génétique |
Remarque : On a décrit des mutations des gènes codant pour ribosome (Ethnies : asie, moyen-orient) à l'origine d'une susceptibilité à l'ototoxicité des aminosides, transmises par les femmes |
|
|
Méthode diagnostique |
Audiogramme si facteurs de risque |
|
|
Traitement |
Hypoacousie et surdité NON APPAREILLABLE |
|
|
Prévention |
Eviter de cumuler les facteurs de risque |
|
|
Eviter les autres traitements nephrotoxiques et ototoxiques |
||
|
Dosage plasmatique des aminosides |
||
|
C - Atteinte neuromusculaire |
||
|
Potentialise les curares |
||
|
=> risque d'arret respiratoire en post-opératoire |
||
|
Facteurs de risques : |
acidose respiratoire |
|
|
myasthénie |
||
|
periode immédiatement post-opératoire |
||
|
application sur les séreuses |
||
|
Traitement |
anti-cholinestérasiques (prostigmine) |
Surveillance des effets
Les indications sont contrôlées par l’antibiogramme et l’efficacité par la clinique. Leur posologie doit être adaptée à la clairance rénale. Dans les infections les plus sévères, les dosages plasmatiques au pic permettent de vérifier que les concentrations efficaces sont atteintes. A l’inverse, les concentrations résiduelles évaluent la qualité de l’élimination et par conséquent le risque toxique.